
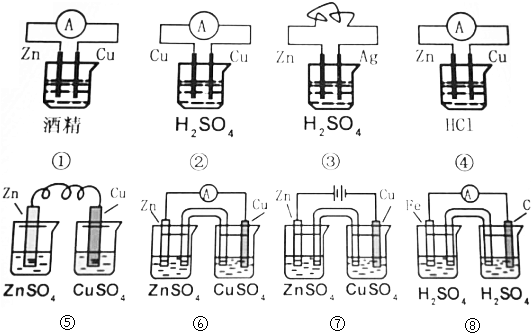
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:①酒精是非电解质,不导电,不能形成原电池;
②两个电极相同,都是Cu,不能构成原电池;
③Zn、Ag和稀硫酸形成原电池,Zn为负极,Ag为正极,可形成原电池;
④Zn、Cu和盐酸形成原电池,Zn为负极,Cu为正极,可形成原电池;
⑤没有形成闭合回路,不能形成原电池;
⑥能形成原电池,活泼性强的金属Zn失电子作负极,Cu为正极,正极上铜离子得电子;
⑦有外加电源不是原电池,是电解池;
⑧Fe直接与硫酸接触发生置换反应生成氢气,不能形成原电池.
答:不能形成原电池的是①②⑤⑦⑧;形成原电池的是③④⑥.
点评 本题考查了原电池的判断,题目难度不大,注意把握原电池的构成条件,四个条件必须都具备才能形成原电池,侧重于考查学生的分析能力.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
 )是临床上一种降脂抗血栓药物,它的一条合成路线如图:
)是临床上一种降脂抗血栓药物,它的一条合成路线如图: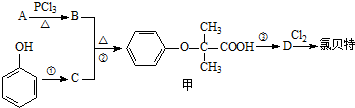
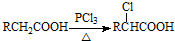
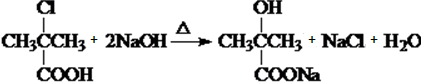 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ③ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a通入CO2,然后b通入NH3,c中放碱石灰 | |
| B. | a通入NH3,然后b入CO2,c中放蘸稀硫酸的脱脂棉 | |
| C. | b通入NH3,然后a通入CO2,c中放碱石灰 | |
| D. | b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的稀硫酸中含有的H+数为0.1NA | |
| B. | 1mol苯分子中含有的碳碳双键数为3NA | |
| C. | 18gH2O中含有的质子数为10NA | |
| D. | 50mL12mol•L-1的盐酸与足量的MnO2共热,生成的Cl2分子数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论解释 | |
| A | 过量铁粉加稀硝酸充分反应,滴入KSCN溶液 | 产生红色溶液 | 稀HNO3将铁氧化成Fe3+ |
| B | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗一批作了银镜反应的试管,配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗实验. | 用FeCl3溶液清洗比Fe2(SO4)3溶液清洗得干净 | 他们认为Fe3+氧化银单质的过程可能是一个可逆过程:Fe3++Ag?Fe2++Ag+ |
| C | 苯酚钠溶液中通入少量CO2气体 | 溶液变浑浊 | 碳酸酸性强于苯酚,溶液中还有Na2CO3生成 |
| D | 相饱和碳酸钠溶液通过量CO2气体 | 产生沉淀 | 因为析出Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和溴水共热 | B. | 光照甲苯与氯气的混合物 | ||
| C. | 溴乙烷与NaOH溶液共热 | D. | 乙烷通入溴的四氯化碳溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com