
| A. | Na+、K+、Cl-、AlO2- | B. | Ba2+、NO3-、HCO3-、Br- | ||
| C. | Cu2+、K+、S2-、SO42- | D. | K+、SO32-、NO3-、MnO4- |
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的蓝色石蕊试纸变红,该气体水溶液一定显酸性 | |
| C. | 某无色溶液中加硝酸钡溶液,再加入盐酸,沉淀不溶解,则溶液中一定有SO42- | |
| D. | 某无色溶液中加盐酸,产生无色气体,溶液中一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将3molNH4NO3溶于一定浓度的稀氨水中,溶液呈中性,溶液中一定含有3NA个NH4+ | |
| B. | 标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L | |
| C. | 10g质量分数为46%的乙醇水溶液中,氢原子的总数为1.2NA | |
| D. | 1L 1mol•L-1的碳酸钠溶液中钠离子的数目小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
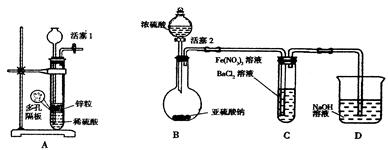
| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
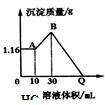 把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)
把NaOH、MgSO4、Al2(SO4)3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浊液中逐滴加入2mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如图.试回答:(写出计算过程)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的焰色呈黄色,说明该物质一定含有钠元素,不含钾元素 | |
| B. | 氧化钠和过氧化钠和酸均能反应生成盐和水,因此都是碱性氧化物 | |
| C. | 氧化钠和过氧化钠的阴阳离子比前者为1:2,后者为1:1 | |
| D. | 把过氧化钠投入滴有酚酞的水中,溶液先变红后褪色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

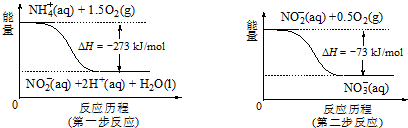
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com