
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞显红色的溶液:Na+、Mg2+、NO3-、HSO3-
B.0.1 mol·L-1 Fe(NO3)2溶液:H+、Al3+、SO42-、Cl-
C.0.1 mol·L-1氨水溶液:K+、Na+、NO3-、AlO2-
D.由水电离出的c(H+)=10-11mol·L-1的溶液:Ca2+、NH4+、Cl-、HCO3-
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:2013-2014学年江西省南昌市高三3月第一次模拟考试理综化学试卷(解析版) 题型:填空题
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:

(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为: 。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式:

①AB段: ;
②BC段 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
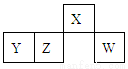
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.最简单气态氢化物的热稳定性:Z>W
D.X与氢元素组成的化合物XH5与水反应可产生两种气体
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
一定温度下,将0.1molAgCl加入1L 0.1mol·L-1Na2CO3溶液中,充分搅拌(不考虑液体体积变化),已知:Ksp(AgCl)=2×10-10;Ksp(Ag2CO3)=1×10-11,下列有关说法正确的是
A.沉淀转化反应2AgCl(s)+ CO32-(aq) Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
Ag2CO3(s)+2Cl-(aq)的平衡常数为20mol·L-1
B.约有2×10-5mol AgCl溶解
C.反应后溶液中的:c(Na+)>c (Cl-) >c (CO32-) >c (OH-) >c (H+)
D.反应后溶液中的:c(Na+)+ c (H+)+ c (Ag+)=2 c (CO32-)+ c (HCO3-)+ c (Cl-)+ c (OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.氯气通入水中:Cl2 + H2O  2H+ + Cl-+ClO-
2H+ + Cl-+ClO-
B.氢氧化铁胶体中加入HI溶液:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
C.NaAlO2溶液中通入过量CO2:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓+ CO32-
D.用稀硝酸除去试管内壁银:3Ag+ 4H+ + NO3- = 3Ag+ + NO↑ +2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:

①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1=-57.3 kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
下列物质间的转化关系中不能全部通过一步反应完成的是
A.Na→NaOH→Na2CO3→NaCl B.Mg→MgCl2→MgCO3→Mg(OH)2
C.Al→Al2O3→Al(OH)3→AlCl3 D.Fe→FeCl3→Fe(OH)3→Fe2O3
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)工业合成氨与制备硝酸一般可连续生产,流程如下:
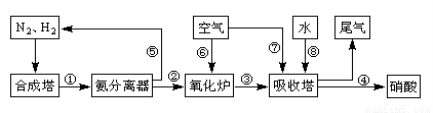
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
T/℃ | T1 | 300 | T2 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
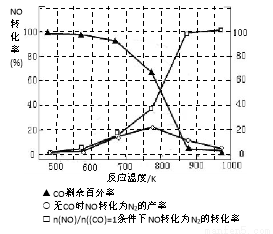
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:选择题
常温下,下列有关物质的量浓度关系正确的是( )
A.等物质的量浓度的溶液中,水电离出的c(H+):HCl>CH3COOH
B.pH相同的溶液中:c(Na2CO3)<c(NaHCO3)
C.在Na2SO3溶液中:c(Na+)= 2c(SO32-)+ c(HSO3-)+ c(OH-)
D.0.1mol·L-1NaHS溶液中:c(Na+)= c(HS-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com