
| A. | 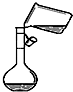 向容量瓶中转移溶液 | B. |  制氢氧化亚铁 | ||
| C. | 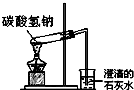 碳酸氢钠受热分解 | D. |  萃取 |
分析 A.转移需要玻璃棒引流;
B.应在液面下加NaOH溶液,防止生成的氢氧化亚铁被氧化;
C.碳酸氢钠加热有水生成,要防止生成的水倒流;
D.利用分液漏斗可分离分层的液体.
解答 解:A.转移需要玻璃棒引流,图中缺少玻璃棒,故A错误;
B.应在液面下加NaOH溶液,防止生成的氢氧化亚铁被氧化,图中加液体的方法不合理,故B错误;
C.碳酸氢钠加热有水生成,要防止生成的水倒流,图中试管口应略向下倾斜,故C错误;
D.利用分液漏斗可分离分层的液体,则图中装置、仪器合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、实验装置及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
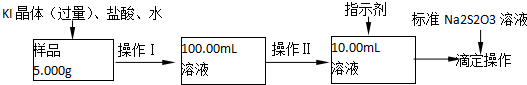
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式M(g)+3N(g)?2R(g)△H>0 | |
| B. | 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 | |
| C. | 达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小 | |
| D. | 达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
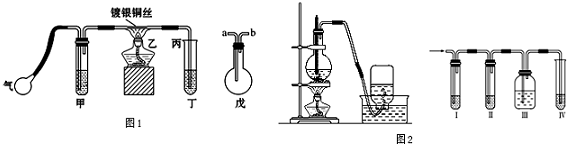
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种氧化物对应的水化物中,Al(OH)3酸性最强 | |
| B. | 向沉淀X中逐滴加入硝酸,沉淀慢慢溶解 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com