
下列变化过程中,需要加入氧化剂的是( )
A.HCl→H2 B.Fe→FeCl3
C.CaCO3→CO2 D.浓H2SO4→SO2
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | K a=1.75×10-5 | K a=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
A.25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3
B.将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:
SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
按下述实验方法制备气体,合理又实用的是( )
A.锌粒与稀HNO3反应制备H2
B.加热分解NH4Cl固体制NH3
C.亚硫酸钠与浓H2SO4反应制备SO2
D.大理石与稀H2SO4反应制备CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里用二氧化锰与浓盐酸反应来制取适量的氯气,反应方程式为MnO2+4HCl(浓)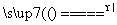 MnCl2+Cl2↑+2H2O。现用100 mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6 L,计算:
MnCl2+Cl2↑+2H2O。现用100 mL的浓盐酸与二氧化锰反应,生成的氯气在标准状况时的体积为5.6 L,计算:
(1)用双线桥标出电子的转移。
(2)理论上需要参加反应的二氧化锰多少克?
(3)被氧化的HCl的质量为多少克?
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池组成正确的是( )
| 选项 | 正极 | 负极 | 电解质溶液 |
| A | Zn | Al | CuSO4 |
| B | Zn | Cu | CuSO4 |
| C | Cu | Zn | CuCl2 |
| D | Cu | Zn | ZnCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在Cl2、Fe2+、Mg、H2O、Cu2+中:
(1)只能做氧化剂的是________,实例:________。
(2)只能做还原剂的是________,实例:________。
(3)H2O作为氧化剂的反应实例:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
含H-的化合物跟氨反应:H-+NH3===NH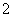 +H2。根据该反应事实,可以得出的正确结论是
+H2。根据该反应事实,可以得出的正确结论是
)
A.NH3具有还原性
B.含H-的化合物是强氧化剂
C.H2既是氧化产物又是还原产物
D.该反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是( )
A.硫在空气中燃烧
B.铜片与浓硫酸共热
C.红热的木炭与浓硫酸反应
D.亚硫酸钠与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃、1.01×105 Pa下,将22 g CO2通入1 mol·L-1 NaOH溶液750 mL中充分反应,测得反应放出x kJ热量。在该条件下,1 mol CO2 通入2 mol·L-1 NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
通入2 mol·L-1 NaOH溶液1 L中充分反应放出y kJ热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
A.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)====NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D.CO2(g)+NaOH(l)====NaHCO3(l) ΔH=-(8x-2y) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com