
| A. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
分析 A.氮气和CO的摩尔质量都是28g/mol,都是双原子分子,根据n=$\frac{m}{M}$计算出混合物的物质的量及含有原子数;
B.没有告诉在标准状况下,不能使用22.4L/mol计算;
C.标准状况下,四氯化碳的状态不是气态;
D.常温常压下,不能使用标准状况下的气体摩尔体积计算.
解答 解:A.14gN2与CO的物质的量为:$\frac{14g}{28g/mol}$=0.5mol,0.5molN2与CO组成的混合气体含有1mol原子,含有的原子数目为NA,故A正确;
B.没有指出在标准状况下,不能使用标准状况下的气体摩尔体积计算,故B错误;
C.标准状况下,四氯化碳为液态,不能使用标准状况下的气体摩尔体积计算三氧化硫的物质的量,故C错误;
D.不是标准状况下,不能使用标准状况下的气体摩尔体积计算混合气体的物质的量,故D错误;
故选A.
点评 本题考查了物质的量的计算,题目难度不大,明确标准状况下气体摩尔体积的使用条件为解答结构,注意熟练掌握物质的量与摩尔质量、阿伏伽德罗常数之间的关系,试题培养了学生的化学计算能力.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是加入氢氧化钠固体 | |
| B. | 常温下,0.4 mol/LHB溶液和0.2 mol/LNaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 某温度下纯水的c(H+)=1.0×10-6mol/L,在此温度下,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合(溶液体积变化忽略不计).欲使混合溶液的pH=7,则氢氧化钡溶液与盐酸的体积比为2:9 | |
| D. | pH相等的下列溶液:a.CH3COOK、b.NaHCO3、c.Na2CO3、d.NaOH,其物质的量浓度由小到大顺序为:d<c<a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
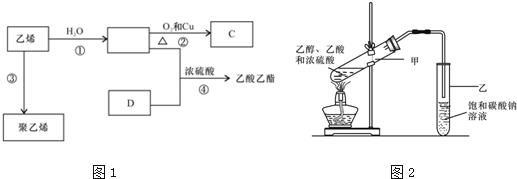
 .
. CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.
CH3COOCH2CH3+H2O,反应类型:酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
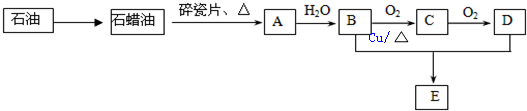
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
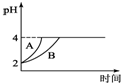 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 加入少量CH3COONa固体后,c(CH3COO-)降低 | |
| C. | 该溶液中由水电离出的 c(H+)是 1.0×10-11mol/L | |
| D. | 与等体积pH=11 的NaOH 溶液混合后所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配位体是Cl-和NH3,配位数是8 | |
| B. | 中心离子是Co2+,配离子是Cl- | |
| C. | 内界和外界中的Cl的数目比是1:2 | |
| D. | 加入足量AgNO3溶液,所有Cl-一定被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 该有机物属于饱和烷烃 | |
| B. | 该烃与2,5-二甲基-3-乙基己烷互为同系物 | |
| C. | 该烃的名称是3-甲基-5-乙基庚烷 | |
| D. | 该烃的一氯取代产物共有8种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com