
分析 (1)硫酸氢钠少量,离子方程式按照硫酸氢钠的化学式组成书写,碳酸氢根离子部分反应;
(2)还原性Fe2+>Br-,亚铁离子优先被氧化,溴离子有1/3的被氧化时,亚铁离子已经完全被氧化,根据溴化亚铁的化学式计算出参加反应的亚铁离子和溴离子的物质的量之比,再计算出反应的化学方程式.
解答 解:(1)少量NaHS04溶液和Ba(HC03)2溶液,反应生成碳酸氢钠、硫酸钡沉淀、二氧化碳气体和水,反应的离子方程式为:H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O,
故答案为:H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O;
(2)亚铁离子的还原性大于溴离子,亚铁离子优先被氧化,有1/3的Br-被氧化,则亚铁离子完全被氧化,参加反应的亚铁离子和溴离子的物质的量之比为:1:(2×$\frac{1}{3}$)=3:2,反应的离子方程式为:6Fe2++4Br-+5Cl2═6Fe3++2Br2+10Cl-,
故答案为:6Fe2++4Br-+5Cl2═6Fe3++2Br2+10Cl-.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的书写原则,试题侧重考查反应物过量情况对生成物的影响,有利于培养学生灵活应用基础知识的能力.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题

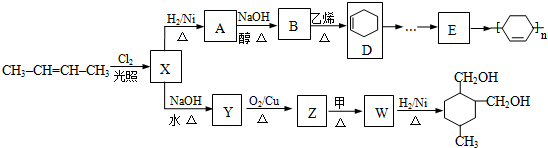
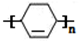
 ;Z→W
;Z→W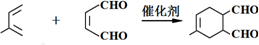 .
.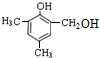 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能被银氨溶液氧化 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 1mol该有机物只能与1mol H2发生加成反应 | |
| D. | 1mol该有机物只能与1mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述弱酸溶液的pH=4 | |
| B. | 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大 | |
| C. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH=7 | |
| D. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L的己烷所含的分子数为0.5 NA 个 | |
| B. | 28 g乙烯所含共用电子对数目为6 NA个 | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA个 | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为6 NA个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com