
(1)现有0.1 mol/L的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是:
第一步,把小块pH试纸放在表面皿(或玻璃片)上,
第二步,________.
(2)该纯碱溶液呈碱性的原因(用离子方程式表示)是________,在常温条件下,你认为该溶液pH的范围一定介于7至________之间.
(3)为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10 m) |
0.74 | 1.6 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低正化合价 | -2 | -3 | -1 | -3 |


查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| M |
| m |
| M |
| 2mNA |
| M |
| 2mNA |
| M |
| 22.4m |
| M |
| 22.4m |
| M |
| m |
| (m+1000) |
| m |
| (m+1000) |
| 18V |
| 11.2 |
| 18V |
| 11.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 原子半径 *10-10 m |
1.52 | 1.11 | 0.70 | 0.66 | 1.86 | 1.60 | 1.11 | 1.04 | 0.99 |
| 最高正价最低负价 | +1 | +2 | +5 -3 |
-2 |
+1 | +2 | +5 -3 |
+6 -2 |
+7 -1 |
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ||||||||
| 3 | ||||||||


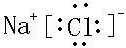
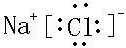
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 原子半径 *10-10 m |
1.52 | 1.11 | 0.70 | 0.66 | 1.86 | 1.60 | 1.11 | 1.04 | 0.99 |
| 最高正价最低负价 | +1 | +2 | +5 -3 |
-2 |
+1 | +2 | +5 -3 |
+6 -2 |
+7 -1 |
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ||||||||
| 3 | ||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com