
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇 | |
| C. | 溴苯水解后,滴加硝酸酸化的硝酸银溶液检验水解产物中的溴离子 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
分析 A.二甲苯存在邻、间、对三种;二甲苯与四甲苯的苯环上存在等效的H原子;
B.1-丙醇中含4种H,2-丙醇中含3种H;
C.水解后在酸性溶液中检验溴离子;
D.油脂不是高分子.
解答 解:A.二甲苯存在邻、间、对三种;二甲苯与四甲苯的苯环上存在等效的H原子,则二甲苯和四甲苯均有三种,故A正确;
B.1-丙醇中含4种H,2-丙醇中含3种H,则利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇,故B正确;
C.水解后在酸性溶液中检验溴离子,则溴苯水解后,滴加硝酸酸化的硝酸银溶液检验水解产物中的溴离子,故C正确;
D.油脂不是高分子,油脂皂化反应中不存在大分子,只有石油裂解是由高分子物质生成小分子物质的过程,故D错误;
故选D.
点评 本题考查有机物的鉴别及检验,为高频考点,把握物质的性质、有机物的组成及结构等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 硝酸银、氨水 | B. | 硫酸亚铁溶液、氢氧化钠溶液 | ||
| C. | 明矾溶液、氢氧化钡溶液 | D. | 氯化铝溶液、氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗1 mol CH3CH2OH时转移电子的物质的量为4mol | |
| B. | 1mol/L CH3COOH溶液中含有σ键的数目为7NA个 | |
| C. | H2F+、NH2-、H2S、CH4均与H2O互为等电子体 | |
| D. | 在配合物[Cr(H2O)6]3+中,H、O原子与中心离子Cr3+形成配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | S | SCl2 | S2Cl2 |
| 沸点/℃ | 445 | 59 | 137 |
| 熔点/℃ | 113 | -122 | -77 |
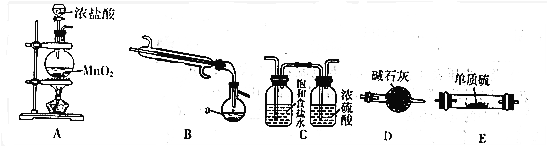
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的醋酸与pH=11的氢氧化钾 | |
| B. | 0.1 mol/L的盐酸与0.1 mol/L的氨水 | |
| C. | 0.001 mol/L的盐酸与pH=11的氨水 | |
| D. | pH=3的盐酸与0.001 mol/L的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
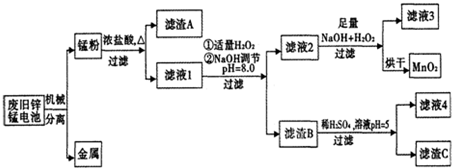
| 物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2/Mn(OH)3 |
| 开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
| 完全沉淀pH (c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x的数值是2 | |
| B. | A的转化率为50% | |
| C. | B的平衡浓度为2mol/L | |
| D. | 反应前后混合气体的压强之比为22:25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com