
【题目】下列图中的实验方案,能达到实验目的的是( )
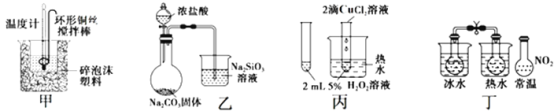
A.图甲:进行中和热的测定
B.图乙:比较 HCl、H2CO3和H2SiO3的酸性强弱
C.图丙:验证 CuCl2对 H2O2 分解有催化作用
D.图丁:验证 2NO2(g)![]() N2O4 (g) △H<0
N2O4 (g) △H<0
科目:高中化学 来源: 题型:
【题目】氰化钾是一种剧毒物质,贮存和使用时必须注意安全。已知:![]() 。回答下列问题:
。回答下列问题:
(1)![]() 中所含三种元素的第一电离能从大到小的顺序为____________________(用元素符号表示,下同),电负性从大到小的顺序为__________,基态氮原子最外层电子排布式为__________。
中所含三种元素的第一电离能从大到小的顺序为____________________(用元素符号表示,下同),电负性从大到小的顺序为__________,基态氮原子最外层电子排布式为__________。
(2)与![]() 互为等电子体的分子为__________(任举一例)。
互为等电子体的分子为__________(任举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸(![]() )是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
)是制备感光树脂的重要原料,某肉桂酸粗产品中含有苯甲酸及聚苯乙烯,各物质性质如表:
名称 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 水中溶解度(25℃) |
苯甲醛 | 106 | -26 | 179.62 | 微溶 |
聚苯乙烯 | 104n | 83.1~105 | 240.6 | 难溶 |
肉桂酸 | 148 | 135 | 300 | 微溶(热水中易溶) |
实验室提纯肉桂酸的步骤及装置如下(部分装置未画出),试回答相关问题:
2g粗产品和30mL热水的混合物![]()
![]() 滤液
滤液![]()
![]() 称重
称重
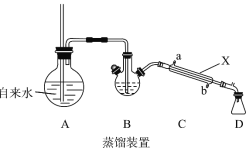
(1)装置A中长玻璃导管的作用是_________,步骤①使苯甲醛 随水蒸汽离开母液,上述装置中两处需要加热的仪器是____________(用字母 A、B、C、D回答)。
(2)仪器X的名称是_______,该装置中冷水应从___________口(填a或b)通入。
(3)步骤②中,10%NaOH溶液的作用是___________,以便过滤除去聚苯乙烯杂质。
(4)步骤④中,证明洗涤干净的最佳方法是________,若产品中还混有少量NaCl,进一步提纯获得肉桂酸晶体方法为_________________。
(5)若本实验肉桂酸粗产品中有各种杂质50%,加碱溶解时损失肉桂酸10%,结束时称重得到产品0.6g,若不计操作损失,则加盐酸反应的产率约为_____%(结果精确至0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数逐渐增大的A、B、C、D、E五种短周期主族元素的部分信息如下表:
元素代号 | 信息 |
A | 原子的最外层电子数为内层电子总数的3倍 |
B | 金属性最强的短周期元素 |
C | 原子的最外层电子数是次外层的 |
D | 原子是最外层电子数A原子的最外层电子数的一半 |
E | 最高价氧化物对应的水化物是最强的无机酸 |
请根据以上信息回答问题。
(1)C的氧化物的化学式为_______________A原子结构示意图为_______________。
(2)B、C、D形成的单质的熔点从低到高的顺序为_______________(填元素符号)。
(3)A、C所形成的化合物的晶体结构与氯化钠晶体结构相似,则晶胞中每个阳离子周围等距且紧邻的阴离子数目为_______________,晶体中阴、阳离子个数比为_______________。
(4)A、D所形成晶体的熔点比C、E所形成晶体的熔点_______________(填“高”或“低”),原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰是制取其他含锰化合物的原料,也可用作脱硫的催化剂等。一种焙烧氯化铵和菱锰矿粉制备高纯度碳酸锰的工艺流程如图所示
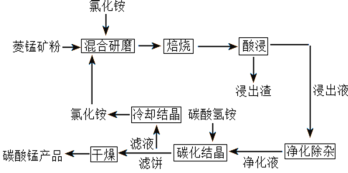
已知①菱锰矿粉的主要成分是MnCO3,还有少量的Fe、Al、Ca、Mg等元素
②常温下,相关金属离子在浓度为0.1mol/L时形成M(OH)n沉淀的pH范围如表
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,Ksp(CaF2)=1.46×1010,Ksp(MgF2)=7.42×1011;Ka(HF)=1.00×104
回答下列问题:
(1)“混合研磨”的作用为_______________________
(2)“焙烧”时发生的主要反应的化学方程式为_________________________________
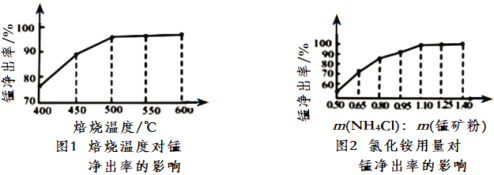
(3)分析图1、图2,焙烧氯化铵、菱锰矿粉的最佳条件是_____________________________
(4)净化除杂流程如下
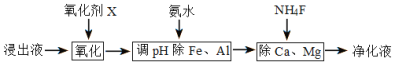
①已知几种物质氧化能力的强弱顺序为(NH4)2S2O8>KMnO4>MnO2>Fe3+,则氧化剂X宜选择__________
A. (NH4)2S2O8 B. MnO2 C. KMnO4
②调节pH时,pH可取的范围为_________________
③常温下加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液中,![]() =______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
=______若此时pH为6,c(Mg2+)= a mol/L,则c(HF)为______________ mol/L (用a表示)
(5)“碳化结晶”过程中不能用碳酸铵代替碳酸氢铵,可能的原因是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
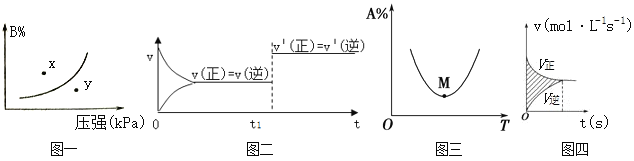
A. 图一表示反应:mA(s)+nB(g)pC(g) △H>O,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,反应速率x点比y点时的慢.
B. 图二是可逆反应:A(g)+B(s)C(s)+D(g) △H>O的速率时间图像,在t1时刻改变条件一定是加入催化剂。
C. 图三表示对于化学反应mA(g)+nB(g) pC(g)+qD(g),A的百分含量与温度(T)的变化情况,则该反应的ΔH>0。
D. 图四所示图中的阴影部分面积的含义是(v正-v逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种弱电解质的pK(pK=-lgK)如下表所示:
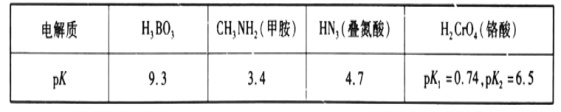
请回答下列问题:
(1)硼酸(H3BO3)在水中存在电离平衡:H3BO3+H2O![]() B(OH)4-+H+。由此推断,硼酸是___(填字母)。
B(OH)4-+H+。由此推断,硼酸是___(填字母)。
A.一元酸 B.三元酸 C.强酸 D.弱酸
(2)常温下,在H3BO3、HN3、H2CrO4中酸性最强的是___(填化学式)。
(3)H2CrO4的二级电离常数表达式Ka2=___。
(4)甲胺在水中的电离和NH3类似,写出CH3NH2在水中的电离方程式:___。
(5)常温下,20mLpH=2的HN3溶液与xmLpH=12的NaOH溶液恰好完全反应,则x___(填“>”“<”或“=”)20mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是s能级和p能级的原子轨道示意图,试回答下列问题:
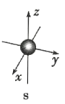
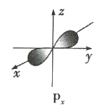
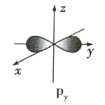
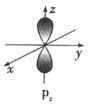
(1)若元素X的原子最外层电子排布式为![]() ,原子中能量最高的是 ____________ 电子,其电子云在空间内有 ____________ 个互相垂直的伸展方向;元素X的名称是 ____________ ,它的简单氢化物的电子式是 ____________ 。
,原子中能量最高的是 ____________ 电子,其电子云在空间内有 ____________ 个互相垂直的伸展方向;元素X的名称是 ____________ ,它的简单氢化物的电子式是 ____________ 。
(2)若元素X的原子最外层电子排布式为![]() ,那么X的元素符号为 ____________ ,原子的轨道表示式为 ____________ 。
,那么X的元素符号为 ____________ ,原子的轨道表示式为 ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究SO2与Cu(OH)2悬浊液的反应。
实验Ⅰ:向NaOH溶液中加入浓CuCl2溶液,制得含Cu(OH)2的悬浊液,测溶液pH≈13。向悬浊液中通入SO2,产生大量白色沉淀,测溶液pH≈3。推测白色沉淀中可能含有Cu+、Cu2+、Cl- 、SO42-、SO32-、HSO3-。
已知: i. Cu(NH3)42+(蓝色);Cu+![]() Cu(NH3)2+(无色);Cu+
Cu(NH3)2+(无色);Cu+![]() Cu+Cu2+
Cu+Cu2+
ii. Ag2SO4微溶于水,可溶于一定浓度的硝酸。
实验Ⅱ:

(1)①通过“白色沉淀A”确定一定存在的离子是____________________。
②判断白色沉淀中金属离子仅含有Cu+、不含Cu2+的实验证据是____________________。
③用以证实白色沉淀中无SO42-、SO32-、HSO3-的试剂a是____________________。
④生成CuCl的离子方程式是____________________。
(2)小组同学基于上述实验认为: SO2与Cu(OH)2悬浊液能发生氧化还原反应不仅基于本身的性质,还受到“生成了沉淀促进了氧化还原反应的发生”的影响。设计实验验证了此观点。
①用实验Ⅰ方法制得含Cu(OH)2的悬浊液,过滤、洗涤获取纯净的Cu(OH)2固体。检验Cu(OH)2固体是否洗涤干净的方法是____________________。
编号 | 实验 | 现象 |
III | 向Cu(OH)2固体中加入一定量的水,制得悬浊液(pH≈8),向悬浊液中通入SO2 | a. 底部产生少量浅黄色沉淀,慢慢消失 b. 静置,底部产生少量红色固体 |
IV | 向CuSO4溶液中通入SO2 | 无沉淀产生 |
②经确认浅黄色沉淀是CuOH,红色固体是Cu,证明SO2与Cu(OH)2悬浊液发生了氧化还原反应。最终生成Cu的原因是____________________。
③由实验III、IV可以得出的结论除“生成了沉淀促进了氧化还原反应的发生” 外还有____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com