
把适合题意的图像填在横线上(用A、B、C、D表示)
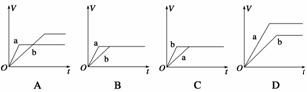
(1)将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是________。
(2)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的CuSO4溶液,产生H2的体积V(L)与时间t(min)的关系是_____ ___
___
(3)将(1)中的CuSO4溶液改成CH3COONa溶液,其他条件不变,则图像是________。
科目:高中化学 来源: 题型:
室温下,0.1mol/L的硫化钠溶液和0.1mol.L的碳酸钠溶液,碱性更强的是_______,其原因是________。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15
H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
查看答案和解析>>
科目:高中化学 来源: 题型:
300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如
下反应:3A(g)+B(g) 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1) 在2 min末时,B的平衡浓度为____________,A的平均反应速率为_____________。
(2) 若温度不变,缩小容器容积,则平衡__________________ (填“向正反应方向移动”、“ 向逆反应方向移动”或“不移动”)。
(3) 能判断该反应是否达到化学平衡状态的依据是____________
A.容器中压强不变
B.混合气体中c(C)不变
C.υ生成(D)=υ消耗(D)
D.2c(B)=c(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是 ( )
A.A>B>C>D>E B.A>C>D>B>E
 C.C>A>B>D>E D.B>D>C>A>E
C.C>A>B>D>E D.B>D>C>A>E
查看答案和解析>>
科目:高中化学 来源: 题型:
以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法:
(1)酸性条件
燃料电池总反应式:CH4+2O2===CO2+2H2O ①
燃料电池正极反应式:O2+4H++4e-===2H2O ②
①-②×2,得燃料电池负极反应式:________________________________________
________________________________________________________________________。
(2)碱性条件
燃料电池总反应式:CH4+2O2+2NaOH===Na2CO3+3H2O ①
燃料电池正极反应式:O2+2H2O+4e-===4OH- ②
①-②×2,得燃料电池负极反应式:_______________________________________
________________________________________________________________________。
(3)固体电解质(高温下能传导O2-)
燃料电池总反应式:CH4+2O2===CO2+2H2O ①
燃料电池正极反应式:O2+4e-===2O2- ②
①-②×2,得燃料电池负极反应式:______________________________________
________________________________________________________________________。 (4)熔融碳酸盐(如:熔融K2CO3)环境下
电池总反应式:CH4+2O2===CO2+2H2O ①
正极电极反应式:O2+2CO2+4e-===2CO ②
②
①-②×2,得燃料电池负极反应式:_______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,下列说法正确的是 ( )
A.处理过程中银器一直保持恒重
B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S===6Ag+Al2S3
D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是 ( )

A.光伏发电是将太阳能转变为电能
B.上图中N区半导体为负极,P区半导体为正极,电流从a流向b
C.YAG中钇显+3价
D.Ga与N在元素周期表中不处于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,下列叙述正确的是
A. pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+)
B. pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍
C. AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同
D. 1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小
| |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com