
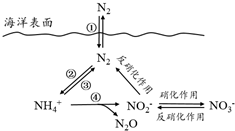
 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.
氮元素在海洋中的循环,是整个海洋生态系统的基础和关键.海洋中无机氮的循环过程可用如图表示.| 温度/℃ | 样本氨氮含量/mg | 处理24h | 处理48h |
| 氨氮含量/mg | 氨氮含量/mg | ||
| 20 | 1008 | 838 | 788 |
| 25 | 1008 | 757 | 468 |
| 30 | 1008 | 798 | 600 |
| 40 | 1008 | 977 | 910 |
分析 (1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程为固氮作用,即单质变化为化合物;
(2)a.海洋中不存在游离态的氮,氮元素是以化合态存在;
b.转化关系图可知海洋中的氮循环起始于氮的氧化;
c.反硝化作用是指将硝酸盐转变成氮气的过程.硝化作用是指氨在微生物作用下氧化为硝酸的过程.硝化细菌将氨氧化为硝酸的过程.反硝化作用:反硝化细菌在缺氧条件下,还原硝酸盐,释放出分子态氮(N2)或一氧化二氮(N2O)的过程;
d.转化关系图中硝酸根离子增多,反硝化作用增强;
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,生成N2O、NO2-、H+和水,结合电荷守恒和原子守恒配平书写离子方程式得到;
(4)硝化细菌去除氨氮的最佳反应温度是处理24h和处理48h后氨氮含量最少的处理效果好,速率是单位时间内氨氮质量的变化计算;
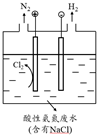
(5)①装置图分析可知和电源正极相连的为阳极,溶液中氯离子在阳极失电子生成氯气,氯气具有强氧化性酸性溶液中能氧化铵根离子为氮气除去;
②结合电解池中的电极反应和生成H2和N2的物质的量之比为3:1,依据电极反应中电子守恒计算溶液中氢离子浓度减小和氢离子浓度增加,判断溶液PH变化;
解答 解:(1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程为固氮作用,即单质变化为化合物,分析转化关系图可知只有反应②是氮气保护为铵根离子是固氮作用,
故答案为:②;
(2)a.海洋中不存在游离态的氮,氮元素是以化合态存在,主要是硝酸根离子,故a错误;
b.转化关系图可知海洋中的氮循环起始于氮的氧化,大气氧化生成氧化物,反应得到铵根离子最后通过硝化作用得到硝酸根离子,故b正确;
c.反硝化作用是指将硝酸盐转变成氮气的过程.硝化作用是指氨在微生物作用下氧化为硝酸的过程.硝化细菌将氨氧化为硝酸的过程.反硝化作用:反硝化细菌在缺氧条件下,还原硝酸盐,释放出分子态氮(N2)或一氧化二氮(N2O)的过程,不一定有氧参加,故c错误;
d.转化关系图中硝酸根离子增多,反硝化作用增强,向海洋排放含NO3-的废水会影响海洋中NH4+的含量,故d正确;
故答案为:ad;
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,生成N2O、NO2-、H+和水,氮元素化合价-3价变化为+1价和+3价,氧元素化合价0价变化为-2价,电子转移总数20e-,所以铵根离子前为4,氧气前为5,NO2-前为2,N2O前为1,结合电荷守恒得到氢离子前为6,水分子式前为5,配平得到离子方程式为:4NH4++5O2═2NO2-+6H++N2O+5H2O,
故答案为:6,N2O,5H2O;
(4)硝化细菌去除氨氮的最佳反应温度是处理24h和处理48h后氨氮含量最少的温度是25°C,处理效果好,在最佳反应温度时,48h内去除氨氮反应的平均速率=$\frac{\frac{1008mg-468mg}{10L}}{48h}$=1.125mg/(L•h)
故答案为:25℃,1.125;
(5)①装置图分析可知和电源正极相连的为阳极,溶液中氯离子在阳极失电子生成氯气,电极反应为:2Cl--2e-=Cl2 ↑,氯气具有强氧化性酸性溶液中能氧化铵根离子为氮气除去,
故答案为:阳极反应2Cl--2e-=Cl2,产生的Cl2氧化废水中的NH4+释放出N2;
②电解池中阳极电极反应是:2Cl--2e-=Cl2↑,3Cl2+2NH4+=N2+8H++6Cl-,阴极电极反应为:2H++2e-=H2↑,若生成n (H2):n (N2)=3:1,电子守恒得到6H+~3H2~6e-~N2~3Cl2~6e-~8H+,阳极产生的H+比阴极消耗的H+多,ry PH减小,
故答案为:减小,理由:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多;
点评 本题考查了含氮元素的物质的综合应用,原电池和电解池原理的分析,注意数据处理方法和转化图中的信息应用,题目难度较大.


科目:高中化学 来源: 题型:解答题
 电池的发明和应用是化学家们对人类社会的重要贡献之一.
电池的发明和应用是化学家们对人类社会的重要贡献之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| /min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反应速率小于4~6min的反应速率 |
| B.2~6min用Cl2表示的反应速率为0.9mol/(L•min) |
| C.增大压强可以提高HCl转化率 |
| D.平衡常数K(200℃)<K(400℃) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na暴露于空气中最终生成Na2O2 | |
| B. | 铜粉能溶于酸性硝酸钠溶解 | |
| C. | Fe比Al更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉会有红棕色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 |  |  |  |  |
| 目的 | 利用乙醇的消去反应制取乙烯 | 验证石蜡油分解的产物是乙烯 | 检验乙烯、乙炔混合气中的乙烯 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中 Mg2+、Al3+、SO42-、CO32- | |
| B. | pH=1的溶液中 NH4+、Ba2+、HCO3-、NO3- | |
| C. | 含MnO4-的溶液中 H+、K+、Br-、I- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中 Na+、K+、CH3COO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3跟稀硝酸反应 | B. | Al(OH)3跟稀硝酸反应 | ||
| C. | CuO跟稀硝酸反应 | D. | Fe(OH)2跟稀硝酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com