
分析 (1)3min时,容器内A的浓度为0.8mol•L,结合ν(A)=$\frac{△c}{△t}$计算;
(2)反应速率之比等于化学计量数之比;
(3)转化的c(A)=$\frac{1mol}{0.5L}$-0.8mol/L=2mol/L-0.8mol/L=1.2mol/L,结合反应计算c(B).
解答 解:(1)3min时,容器内A的浓度为0.8mol•L,结合ν(A)=$\frac{△c}{△t}$=$\frac{2mol/L-0.8mol/L}{3min}$=0.4mol/(L•min),
答:这段时间内v(A)=0.4mol/(L•min);
(2)反应速率之比等于化学计量数之比,则$\frac{0.6}{0.4}=\frac{n}{2}$,解得n=3,
答:n=3;
(3)转化的c(A)=$\frac{1mol}{0.5L}$-0.8mol/L=2mol/L-0.8mol/L=1.2mol/L,由可知,结合2A(g)?B(g)+3C(g)反应,c(B)=1.2mol/L×$\frac{1}{2}$=0.6mol/L,
答:反应到3min时,容器内B浓度为0.6mol/L.
点评 本题考查化学平衡的计算,为高频考点,把握物质的量浓度变化、反应速率与化学计量数的关系等为解答的关键,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
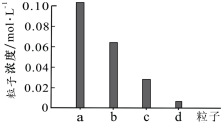 常温下,将0.20mol/L H2X溶液与0.20mol/L NaOH溶液等体积混合,所得溶液pH=3.6,继续滴加NaOH溶液至pH=4.0时,部分粒子浓度如下图所示.下列说法错误的是( )
常温下,将0.20mol/L H2X溶液与0.20mol/L NaOH溶液等体积混合,所得溶液pH=3.6,继续滴加NaOH溶液至pH=4.0时,部分粒子浓度如下图所示.下列说法错误的是( )| A. | 图中a代表Na+,d代表H2X分子 | |
| B. | H2X为二元弱酸,HX-的电离程度大于水解程度 | |
| C. | 混合溶液pH=3.6时:c(H+)+c(H2X)=c(X2-)+c(OH-) | |
| D. | 继续滴加NaOH溶液至pH=7.0时:c(Na+)>c(HX-)+2c(X2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
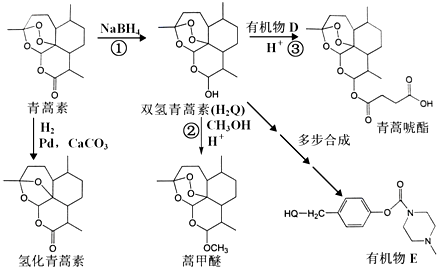
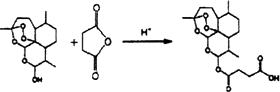 .
.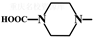 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHCO3溶液中通CO2至pH=7:c(Na+)=c(HCO3-)+2c(CO32-) | |
| B. | 向CH3COONa溶液中加入等浓度等体积的盐酸:c(Na+)=c(Cl-) | |
| C. | 向NaHSO4溶液中加入等浓度等体积的Ba(OH)2溶液:pH=13 | |
| D. | 向氨水中加入少量NH4Cl固体:$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 方案可行.能准确测定溶液中的c(I2) | |
| B. | 方案可行,可采用淀粉做该滴定反应的指示剂 | |
| C. | 不可行.只能测得溶液中c(I2)与c(I3-)之和 | |
| D. | 不可行.因为I-能与Na2S2O3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
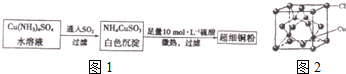
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L H2O含有的分子数为 NA | |
| B. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| C. | 将等物质的量的SO3和SO2溶于水,所得溶液中H+数目相等 | |
| D. | 常温常压下,1.06g Na2CO3溶于水形成的溶液中含有Na+离子数为0.02 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com