
����Ŀ��̼��þ������һ�������������β����е���ǿ����ij������MgCl2(����������FeCl2��FeCl3)Ϊԭ���Ʊ�̼��þ���루MgCO3��H2O���Ĺ����������£�

��֪��Fe3+��Fe2+��Mg2+���������������ʱ��pH
���� | ��ʼ���� | ������ȫ |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mg(OH)2 | 9.9 | 11.1 |
ע��Fe(OH)2��������״�����״���Һ�г�ȥ��
��1��д���������������з��������ӷ�Ӧ����ʽ���õ����ű������ת�Ƶķ������Ŀ ��
��2��pH���ڵķ�Χ ����������Ҫ�ɷ� ���ѧʽ����
��3������X�������ˡ�ϴ�ӡ���ɣ�֤��̼��þ�����Ѿ�ϴ�Ӹɾ��ķ��� ��
��4��ˮ������Һ��Fe2+��Fe3+�����IJⶨ
��ȡˮ������Һ100.00 mL�����Cl��Ũ��Ϊ0.455 mol��L1�������л���ͨ������ʹFe2+ǡ����ȫת��ΪFe3+����ô�ʱ��Һ��Cl��Ũ��Ϊ0.460 mol��L1����Һ����仯���Բ��ƣ���
����ȡˮ������Һ100.00 mL�������м��������1 mol��L1 NaOH��Һ����ַ�Ӧ����ˡ�ϴ�ӡ����գ���ȴ�Ƶù����ĩ������Ϊ0.96 g��
��ͨ������ȷ��ˮ������Һ��Fe2+��Fe3+�����ʵ���Ũ�ȣ�д��������̣���
���𰸡���1��
��2��3.7~9.9Fe(OH)3��3��ȡ�������һ��ϴ��Һ�������м��������ữ��AgNO3��Һ�����ް�ɫ����������֤����ϴ�Ӹɾ���4��c(Fe2+)=0.005mol��L1c(Fe3+)=0.015mol��L1
��������
�����������1��Fe(OH)2��������״�����״���Һ�г�ȥ���������������Fe2+��������Fe3+�����ӷ���ʽΪ�� ����2������pH��Ϊ����Fe3+��ɳ�����ȥ����Mg2+�����������pHֵ�ĵ��ڷ�Χ��3.7��9.9����������Ҫ�ɷ���Fe(OH)3����3��̼��þ������δϴ������Ậ��NH4Cl��Һ�����֤��̼��þ�����Ѿ�ϴ�Ӹɾ��ķ���ȡ�������һ��ϴ��Һ�������м��������ữ��AgNO3��Һ�����ް�ɫ����������֤����ϴ�Ӹɾ���
����2������pH��Ϊ����Fe3+��ɳ�����ȥ����Mg2+�����������pHֵ�ĵ��ڷ�Χ��3.7��9.9����������Ҫ�ɷ���Fe(OH)3����3��̼��þ������δϴ������Ậ��NH4Cl��Һ�����֤��̼��þ�����Ѿ�ϴ�Ӹɾ��ķ���ȡ�������һ��ϴ��Һ�������м��������ữ��AgNO3��Һ�����ް�ɫ����������֤����ϴ�Ӹɾ���
��4���ɹ�ϵʽ��2Fe2+~ Cl2~ 2Cl����֪�����ӵ�Cl-�����ʵ�����ΪFe2+�����ʵ���
n(Fe2+) =100��10-3��(0.460-0.455)=5.0��10-4mol
c(Fe2+)=5.0��10-4��100��10-3=0.005mol��L1
����ijɷ�ΪFe2O3��MgO
��[n(Fe3+)+n(Fe2+)]��0.5��160+n(Mg2+)��40=0.96
������Һ�еĵ���غ���3n(Fe3+)+2n(Fe2+)+2n(Mg2+)=0.455��100��10-3
��n(Fe3+)=1.5��10-3mol
��c(Fe3+)=0.015mol��L1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ���ǣ� ��
A.��Ͷ�뵽ˮ�� 2Na+2H2O�T2Na++2OH��+H2��
B.�Ȼ����Һ��ŨNaOH��Һ���� NH4++OH���TNH3H2O
C.�Ȼ�����Һ�е��������ˮ Al3++3NH3H2O�TAl��OH��3��+3NH4+
D.��Ƭ�����Ȼ�����Һ�� Fe+Fe3+�T2Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�����Ŀ��
��1����CO2�������ͨ�����ʯ��ˮ�У����ֳ���ʯ��ˮ�Ȼ��ǣ����ֱ���壬д���ڸù��������漰�Ļ�ѧ����ʽ��
��2��Cu��Ũ���ᷴӦ�Ļ�ѧ��Ӧ����ʽ�� �����ڴ˷�Ӧ�У�����������ʲô���ʣ�
��3����ˮ��þ�У����ǵ������ǣ��û�ѧ��Ӧ����ʽ��ʾ����
��4����ҵ���Ʊ��ֹ�Ļ�ѧ����ʽ�ǣ�
��5��SiO2�Dz����ijɷ�֮һ��SiO2������������Һ��Ӧ�Ļ�ѧ����ʽΪ �� ����ʦ���������������ƣ�����̲�����
��6����ҵ�ϳ�����̼������ʯӢΪԭ����ȡ��������д����ҵ��ȡ�����Ļ�ѧ��Ӧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֽ���������ɵĻ����11g���ӵ�����ϡ�����У����յõ�11.2L����״���£��������������ֽ��������ǣ� ��
A.Zn��Fe
B.Ag��Mg
C.Al�� Cu
D.Mg��Zn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƴ�����ʳƷ��������������ͼ��ʾ�������г�װ����ʡ�ԣ���ҩƷ��̽����������������ķ�Ӧ�������������ijɷ֡���֪����Һ�����¶ȣ�NO2:21�棻NO��-152 ��
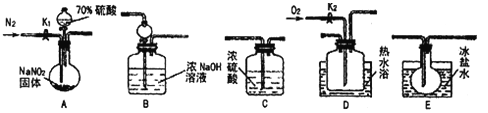
�ش��������⣺
��1��Ϊ�˼���װ��A�����ɵ�����������������˳��Ϊ(������������): A��C��___��____��______��
��2����װ���������������еIJ�����____��ʵ�鿪ʼʱͨ��N2��������______.
��3���رյ���K1����Һ©������������70�������A�в�������ɫ���塣ȷ��A�в����������к���NO�����ݵ�������__________��װ��E��������__________��
��4����������ʵ�飬д���÷�Ӧ�Ļ�ѧ����ʽ��__________��
���û��װ��C������֤������ɵ�Ӱ����__________��
��5��ʵ���������ͨ��N2��������_______�������D��ͨ�����O2����װ��B�з�����Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������SO3����ͨ��KOH��Ba(OH)2��KAIO2�������ʵĻ����Һ�У���ͼ��ʾ���ɳ��������SO3�����ʵ����Ĺ�ϵ�����ͼ����
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��ɫ��Һ�л����ص���NaOH��Һֱ����������������������������NaOH��Һ����Ĺ�ϵ��ͼ��ʾ���ɴ�ȷ����ԭ��Һ�к��е��������ǣ� �� 
A.Mg2+��Al3+��Fe2+
B.H+��Mg2+��Al3+
C.H+��Ba2+��Al3+
D.ֻ��Mg2+��Al3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������ڱ��е�λ��ȡ���ڸ�Ԫ��ԭ�ӵ�(����)��
A. ���ԭ�������ͺ��������
B. ���Ӳ���������������
C. ���ԭ������������������
D. ���Ӳ����ʹ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������У���ij��̼ԭ���������ĸ���ͬ��ԭ�ӻ�ԭ����ʱ������̼ԭ�ӳ�Ϊ������̼ԭ���������磬��ͼ�л�������д���*��̼ԭ�Ӿ�������̼ԭ�ӡ����л���ֱ������з�Ӧ�����ɵ��л���������Ժ�������̼ԭ�ӵ��ǣ�

A. �����ᷢ��������Ӧ
B. ��NaOHˮ��Һ��Ӧ
C. ��������Һ����ֻ����������Ӧ
D. ������������H2��Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com