
下列叙述中,正确的是( )
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
D.某基态原子错误的核外电子排布图为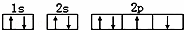 该排布图违背了泡利原理
该排布图违背了泡利原理
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
下列实验装置图正确的是(双选)( )。
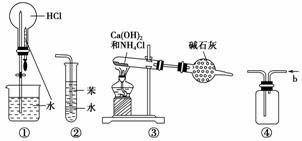
A.装置①可用于做HCl喷泉实验
B.装置②可用于吸收HCl气体,并防倒吸
C.装置③可用于实验室制备少量NH3
D.装置④b口进气可收集CO2等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是(双选)( )
A.甲烷分子的二氯取代物和三氯取代物的同分异构体数目相同
B.苯分子的二氯取代物和三氯取代物的同分异构体数目相同
C.分子式为C4H10O2且可与金属钠反应放出H2的有机化合物共有3种
D.分子式为C4H8O2且可与NaHCO3溶液反应放出CO2的有机化合物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是__________________(用离子反应方程式表示)。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是____________。
(3)在1 mol·L-1的KAl(SO4)2溶液中离子浓度由大到小的顺序是____________。
(4)某小组同学用下图所示装置探究NaClO和KAl(SO4)2饱和溶液混合反应的实验。
①打开活塞向烧瓶中加入饱和KAl(SO 4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是_____________________________________________________。
4)2溶液,产生大量的白色胶状沉淀。反应的离子方程式是_____________________________________________________。
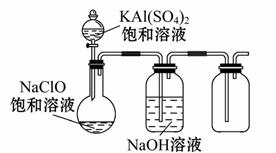
②将烧瓶中的混合液在阳光下照射,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带火星的木条复燃。写出在光照下混合液中反应的化学方程式______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)欲使Na2S(aq)中N(Na+)∶N(S2-)接近2∶1,应加入适量________。
(2)配制FeSO4(aq)时,常加少量Fe粉,目的是________;常加入少量H2SO4,目的是______________。
(3)普通泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒中盛碳酸氢钠溶液,其化学反应的原理是___________。不能把硫酸铝溶液盛在铁筒中的原因是______
______。不用溶解度较大的碳酸钠代替碳酸氢钠的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种元素中,其单质氧化性最强的是( )
A.原子含有未成对电子最多的第二周期元素 B.位于周期表中第三周期ⅢA族的元素
C.原子最外层电子排布为2s22p4的元素 D.原子最外层电子排布为3s23p3的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C三种主族元素,已知A元素原子的价电子构型为nsn,B元素原子的M层上有两个未成对电子,C元素原子L层的p轨道上有一对成对电子,由这三种元素组成的化合物的化学式不可能是( )
A.A3BC4 B.A2BC4 C.A2BC3 D.ABC4
查看答案和解析>>
科目:高中化学 来源: 题型:
冶炼铜矿石所获得的铜通常含有锌、铁、镍、银、金和铂等微量杂质,俗称粗铜。工业上通常通过电解法除去这些杂质制得精铜,以提高铜的使用价值,扩大铜的应用范围。(几种金属的相对原子质量是:Fe-56,Ni-59,Cu-64,Zn-65,Ag-108,Au-197。)
请完成下列问题:
(1)一般来说,电解精炼铜的初始电解质溶液里的阳离子是__________,写出铜的电解精炼过程中的阴极反应式________________________________。
(2)如果转移0.020 mol e-,下列说法中一定正确的是________。
①阴极质量增加0.64 g ②阳极质量减少0.64 g
③电解质溶液的质量保持不变 ④电解质溶液的温度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应:M+N―→P,如果温度每升高10℃,化学反应速率提高到原来的3倍,在10℃时完成反应的10%需要81 min,将温度提高到30℃时,完成反应的10%需要的时间为( )
A.9 min B.27 min C.13.5 min D.3 min
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com