
【题目】以氯酸钠等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法错误的是( )
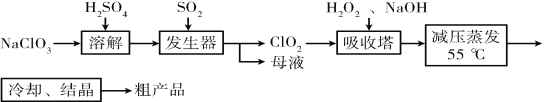
A.吸收塔中1mol H2O2失去2mol电子
B.吸收塔中温度不宜过高,否则会导致H2O2的分解
C.“母液”中含有大量的Na2SO4
D.溶解时能用盐酸代替硫酸以防止引入硫酸根杂质
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.NaCl(aq) ![]() Na(s)
Na(s) ![]() Na2O2(s)
Na2O2(s)
B.SiO2(s) ![]() Si(s)
Si(s) ![]() SiCl4(l)
SiCl4(l)
C.SO2(g) ![]() NH4HSO3(aq)
NH4HSO3(aq) ![]() (NH4)2SO4(aq)
(NH4)2SO4(aq)
D.Cu2(OH)2CO3(s) ![]() CuO(s)
CuO(s) ![]() Cu(OH)2(s)
Cu(OH)2(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 向50mL 1mol·L-1的盐酸中加入烧碱,水的KW不变
B. NH4Cl和NH3·H2O混合液中,二者对对方的平衡都起了抑制作用
C. 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+)
D. 常温0.1mol·L-1HA溶液中c(OH-)/ c(H+)=10-8,则0.01mol·L-1 HA溶液中c(H+)=1×10-4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)现有反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
①如果上述反应的平衡常数K值变大,该反应___(填字母)。
a.一定向正反应方向移动 b.在平衡移动过程中正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动过程中逆反应速率先减小后增大
②若反应容器的容积为2.0L,反应时间4.0min,容器内气体的物质的量减小了0.8mol,在这段时间内CO2的平均反应速率为___。
③在850℃时,若向1L的密闭容器中同时充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),上述反应向___(填“正反应”或“逆反应”)方向进行。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是___。
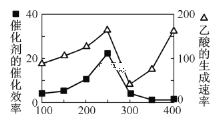
②为了提高该反应中CO2的转化率,可以采取的措施是___。(写一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.7.2g CaO2固体中阴阳离子总数为0.3NA
B.密闭容器中2 mol NO与1mol O2充分反应,产物的分子数目为2NA
C.在一定条件下,6.4g铜与过量的硫反应,转移的电子数目为0.2NA
D.10g质量分数为46%的乙醇溶液中O-H键数目为0.7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4= -1048.9kJ·mol-1
(1)上述反应热效应之间的关系式为ΔH4=______。
(2)联氨分子的电子式_____,联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为______(已知:N2H4+H+ ![]() N2H5+的K=8.7×107;Kw=1.0×10-14)
N2H5+的K=8.7×107;Kw=1.0×10-14)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)可用于制备增塑剂,常温下为无色透明液体,密度1.68g/mL,沸点105.8oC,易挥发,易水解。一中化学兴趣小组探究制备POCl3所需的装置如下图所示:
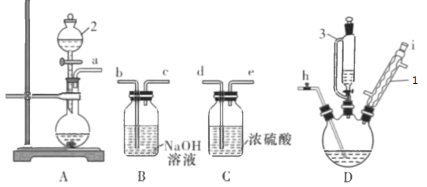
反应原理:![]() (PC13常温下为液态,密度1.57g/mL,沸点75oC,易挥发,易水解)。
(PC13常温下为液态,密度1.57g/mL,沸点75oC,易挥发,易水解)。
(1)仪器3的名称是 ________,仪器2中装入的物质为_______,仪器1的作用是 ___________。
(2)A中发生的反应的离子方程式可能为__________________________________
(3)请组装好上述装置(如有必要可以重复选择),用小写字母连接:_________________。
(4)开始通入氯气,同时慢慢滴加水,控制氯气和水的质量比大于等于3.94,理由是_____________________________________。
(5)准确量取13.75mL PCl3充分反应后经分离提纯得到纯净的POCl3 16.8g,请计算实验的产率为________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气.
I.工业上通常采用电解法制氯气:观察下图,回答:
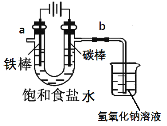
(1)电解反应的化学方程式为____________________。
(2)饱和食盐水通电后,b端产生的气体检验方法是____________。
II. 实验室用NaOH固体配制100 mL 1.0 mol·L-1的NaOH溶液,试回答下列各题:
(3)需要用托盘天平称量_______g NaOH固体;
(4)实验室有下列仪器:①漏斗 ②200mL容量瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥托盘天平 ⑦冷凝。若要实施溶液配制,尚缺的玻璃仪器是___________、________;
(5)容量瓶在使用前必须先____________;
(6)配制过程有以下操作: ①称量 ②移液 ③冷却 ④洗涤 ⑤定容 ⑥溶解 ⑦摇匀 其正确的操作顺序应是:① →_________→________ →________ →________→________→ ⑦
(7)下列五项操作中会导致所得溶液浓度偏低的有____________(填序号);
①没有洗涤烧杯内壁和玻璃棒
②未冷却到室温就将溶液转移到容量瓶并定容
③在转移过程中有溶液撒在外面
④定容时观察液面时俯视
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中常用FeCl3溶液腐蚀覆铜板来制作印刷电路板,并回收Cu和综合利用FeCl3溶液。流程图如下:

请回答:
(1)试剂A是_________ 。
(2)过程①反应的离子方程式是_________。
(3)过程③反应的离子方程式是_________。
(4)检验废液中Fe3+存在的方法是_________。
(5)若在10g滤渣中加入足量盐酸,放出1.12 L H2(标准状况),则滤渣中Cu的质量分数是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com