
将1.52 g的铜镁合金完全溶解于50mL14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加人1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.若该浓硝酸的密度为1.40g/mL则该浓硝酸的溶质质量分数为63% |
| B.该合金中铜与镁的物质的最之比是2:1 |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加人NaOH溶液的体积是620 mL |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
学校附近的湖水中浮萍疯长,助长水质恶化。湖水水样中可能含有Fe3+、Ba2+、K+、H+、NO3-、Cl-、CO32-、SO42-离子。为了进一步确认,取样进行实验检测:
①取水样仔细观察,呈透明、均一状态。
②用pH试纸测定污水的pH,试纸显红色。
③向水样中滴入KSCN溶液,呈红色。
④向水样中滴入稀硫酸,有大量白色沉淀产生,再加稀硝酸,白色沉淀不消失。
(1)由此可知,该污水中肯定含有的离子是_________,肯定没有的离子是_________。
(2) 浮萍疯长的可能原因是水中含有较多的_____________离子。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧后,得到1.02g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65g固体。
依据实验回答下列问题:
(1)由①可知存在的离子为 ,浓度是 mol·L-1。
由②可知存在的离子为 ,浓度是 mol·L-1。
由③可知存在的离子为 ,浓度是 mol·L-1。
(2)该溶液中一定不存在的离子是 (填离子符号)。
(3)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):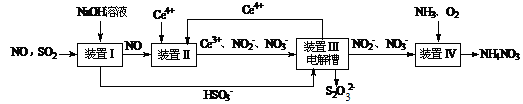
⑴装置Ⅰ中的主要离子方程式为 。3
⑵含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。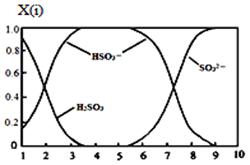
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
⑶写出装置Ⅱ中,酸性条件下的离子方程式 。
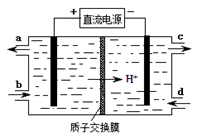
⑷装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
①生成Ce4+从电解槽的 (填字母序号)口流出。②写出与阴极的反应式 。
⑸已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示, 计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
| A.该反应中的氧化剂是C12 |
| B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂 |
| C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12 |
| D.根据该反应可判断还原性:S2O32->C1— |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知反应KClO3+6HCl = KCl+3Cl2↑+3 H2O,下列判断正确的是
| A.KClO3被氧化 |
| B.氧化剂与还原剂之比为1:6 |
| C.氧化产物是Cl2 |
| D.HCl在化学反应中只能作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
| A.无水硫酸铜、蔗糖 | B.硅胶、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2="==2" Ag2S +2H2O,其中H2S是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在热的稀硫酸溶液中溶解11.4g FeSO4。当加入50mL 0.50mol/L KNO3溶液后,使其中的Fe2+全部转化为Fe3+。KNO3溶液也完全反应,并有NxOy气体逸出,此NxOy气体为
| A.N2O | B.N2O3 | C.NO2 | D.NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com