
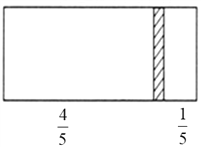
【题目】(1)一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同)。右侧CO与CO2分子数之比为________________;
(2)已知质量分数为28%的氨水物质的量浓度为12 mol·L-l,则质量分数为14%的氨水物质的量浓度_____(填“大于”、“小于”或“等于”) 6 mol·L-l;已知4 mol·L-l 的硫酸溶液密度为![]() ,2 mol·L-l 的硫酸溶液密度为
,2 mol·L-l 的硫酸溶液密度为![]() 。100g浓度为4mol·L-l 的硫酸溶液与________mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含
。100g浓度为4mol·L-l 的硫酸溶液与________mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含![]() 、
、![]() 的式子表示)
的式子表示)
【答案】 3:1 大于 ![]()
【解析】(1)左右两侧气体温度、压强相同,相同条件下,体积之比等于物质的量之比,左右体积之比为4:1,则左右气体物质的量之比为4:1,所以右侧气体物质的量=1mol÷4=0.25mol,CO和二氧化碳质量为8g,设CO的物质的量为xmol,则二氧化碳物质的量为(0.25-x)mol,28x+44×(0.25-x)=8,解得x=3/16mol,则CO的物质的量为3/16mol,二氧化碳物质的量为1/16mol,气体的物质的量之比等于其分子数之比,所以右边CO与CO2分子数之比为3/16mol:1/16mol=3:1;(2)氨水的浓度越大密度越小,根据![]() 可知质量分数为28%的氨水物质的量浓度为12 mol·L-l,则质量分数为14%的氨水物质的量浓度大于6 mol·L-l;100g浓度为4molL-1的硫酸溶液中溶质的物质的量是
可知质量分数为28%的氨水物质的量浓度为12 mol·L-l,则质量分数为14%的氨水物质的量浓度大于6 mol·L-l;100g浓度为4molL-1的硫酸溶液中溶质的物质的量是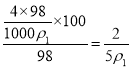 ,设加入水的体积是VmL,能使硫酸的物质的量浓度减小到2molL-1,则
,设加入水的体积是VmL,能使硫酸的物质的量浓度减小到2molL-1,则![]() ,解得
,解得![]() 。
。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】用单线桥法或者双线桥法表示下列氧化还原反应中电子转移的方向和数目,并按要求填空。
(1)(单线桥法) CuO+H2![]() Cu+H2O 被氧化的元素是_____________,
Cu+H2O 被氧化的元素是_____________,
(2)(单线桥法) 2KI+Cl2=2KCl+I2 发生氧化反应的物质是_____________,
(3)(双线桥法) 8NH3+3Cl2=N2+6NH4Cl 还原剂是_____________,
(4)(双线桥法) 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 被还原的元素是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.甲烷和乙烯都可以与氯气反应
B.酸性高锰酸钾可以氧化苯和甲苯
C.乙烯可以与氢气发生加成反应,苯不能与氢气加成
D.溴乙烷在NaOH的醇溶液中充分反应可得到乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
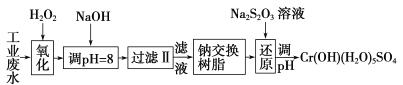
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | ll.l | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗172.8g Cr2O72-转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。
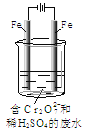
(1)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
(3)上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡影响角度解释其原因_________________。
(4)若溶液中初始含有0.1mol Cr2O72-,则生成的阳离子全部转化化成沉淀的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2是人类赖以生存的物质,O2的摩尔质量为( )
A. 16 g·mol-1 B. 32 g·mol-1
C. 64 g·mol-1 D. 10 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的
A.甲烷的燃烧热为890 kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)![]() CO2(g)+ 2H2O(g) △H=890 kJ/mol
CO2(g)+ 2H2O(g) △H=890 kJ/mol
B.在一定条件下将1 mol SO2和0.5 mol O2置于密闭容器中充分反应,放出热量79.2 kJ,则反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H=158.4 kJ·mol1
2SO3(g) △H=158.4 kJ·mol1
C.中和反应热为57.3 kJ·mol1 NaOH(s)+![]() H2SO4(aq)
H2SO4(aq)![]()
![]() Na2SO4(aq)+H2O(l) △H=57.3 kJ·mol1
Na2SO4(aq)+H2O(l) △H=57.3 kJ·mol1
D.2.00 g C2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6 kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) △H=2589.6 kJ·mol1
4CO2(g)+2H2O(l) △H=2589.6 kJ·mol1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com