
【题目】下列有关电解质溶液的说法不正确的是
A. 向0.1 mol·L-1CH3COOH溶液中加入少量水,溶液中![]() 增大
增大
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中![]() 减小
减小
C. 向盐酸中加入氨水至中性,溶液中![]() =1
=1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 变小
变小
【答案】D
【解析】
A项,Ka=c(H+)×c(CH3COO-)/c(CH3COOH),所以c(H+)/c(CH3COOH)=Ka/c(CH3COO-),加水虽然促进电离,n((CH3COO-)增大,但c(CH3COO-)减小, Ka保持不变,则溶液中c(H+)/c(CH3COOH) 增大,故A项正确;
B项,20 ℃升温至30 ℃,促进CH3COO-水解,且Kh增大,则溶液中c(CH3COO-)/ c(CH3COOH)×c(OH-)=1/Kh减小,故B项正确;
C项,向盐酸中加入氨水至中性,则c(H+)=c(OH-),由电荷守恒可知,溶液中c(NH4+)=c(Cl-),即c(NH4+)/ c(Cl-)=1,故C项正确;
D项,向AgCl、AgBr的饱和溶液中加入少量AgNO3,c(Ag+)相同,则![]() =Ksp(AgCl)/ Ksp(AgBr),Ksp只与温度有关,而温度不变,则溶液中
=Ksp(AgCl)/ Ksp(AgBr),Ksp只与温度有关,而温度不变,则溶液中![]() 不变,故D项错误;
不变,故D项错误;
综上所述,本题选D。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 15g甲基(-CH3)中含有的电子数为9NA
B. 标准状况下,2.24L己烷中所含碳原子数为0.6NA
C. 0.1mol Fe与足量稀硫酸反应时,转移电子数为0.3NA
D. 由2SO2+O2![]() 2SO3可知,2mol SO2与1mol O2充分反应生成SO3分子数为2NA
2SO3可知,2mol SO2与1mol O2充分反应生成SO3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是
A.X >Y>ZB.Z>Y>X
C.X>Z>YD.Y>X>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近湖南都市台报道,长沙市周边农田由于焚烧稻草导致烟雾弥漫,致使高速公路限行,航班停飞。烟雾属于下列分散系中的
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
已知:
名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
苯甲酸 | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入12.20 g苯甲酸,25 mL 95%的乙醇(过量),20 mL环己烷以及4 mL浓硫酸,混合均匀并加入沸石,按下图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
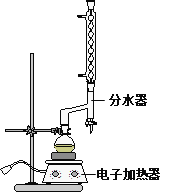
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为12.86 mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是_________(填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①中使用分水器不断分离除去水的目的是_____________________。
(3)步骤②中应控制馏分的温度在____________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(4)步骤③加入Na2CO3的作用是______________________;若Na2CO3加入不足,在之后蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是____________。
(5)关于步骤③中的萃取分液操作叙述正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞,分液漏斗倒转过来,用力振摇
B.振摇几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.放出液体时,应打开上口玻璃塞或将玻璃塞上的凹槽对准漏斗口上的小孔
(6)计算本实验的产率为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是( )
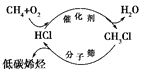
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 上图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想
D. 让煤变成水煤气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应
B.催化裂化不仅可以提高汽油的产量而且可以提高汽油质量
C.裂化汽油可使溴水褪色
D.裂解的目的是获得乙烯、丙烯、丁二烯等短链不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
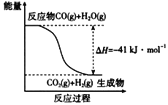
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:反应的热化学方程式为________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则1/2N2(g)+3/2H2(g)![]() NH3(g) ΔH =______________。
NH3(g) ΔH =______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)=CO2(g) ΔH1=akJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH2=bkJ·mol-1,③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=ckJ·mol-1,298K时反应2C(s,石墨)+H2(g)=C2H2(g)的焓变:ΔH =_______________。
(4)已知:铝热反应是放热反应,又知,常温下:4Al(s)+3O2(g)=2Al2O3(s) ΔH1,4Fe(s)+3O2(g)=2Fe2O3(s) ΔH2,下面关于ΔH1、ΔH2的比较正确的是________
ΔH 1>ΔH 2 B.ΔH 1<ΔH 2 C.ΔH 1=ΔH 2 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101 kPa下,如下图所示,石墨的燃烧热为一393.51 kJ·mol-1,金刚石的燃烧热为一395.4kJ·mol-1。下列表达正确的是
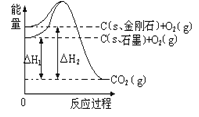
A. 金刚石比石墨稳定
B. C(s、石墨)=C(s、金刚石) △H=+1.9 kJ/mol
C. △H1<△H2
D. 如果使用催化剂,△H1和△H2都变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com