
【题目】下列鉴别物质或离子的方法能达到目的的是
A. 用氨水鉴别MgCl2溶液和AlCl3溶液
B. 用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
C. 用AgNO3鉴别Na2CO3溶液和NaCl溶液
D. 用足量的盐酸和BaCl2溶液鉴别溶液中是否含SO42-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示的原电池装置,下列判断正确的是
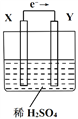
A. 外电路的电流方向为:X→导线→Y
B. 若两电极都是金属,则它们的活动性顺序为X<Y
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 放电一段时间后,烧杯中溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为____________;
(2)第一电离能:S_______ (填“>”“<”或“=”,下同)P;电负性:S________P。
(3)三硫化四磷分子中P原子采取________杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属于__________(填“极性”或“非极性”)分子。
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_______。
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH-之间的距离为acm,晶胞中Na+的配位数为__________,用NA表示阿伏加德罗常数的数值,NaOH的密度为___________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用a装置来制备。完成下列填空:

(1)实验时,通常加入过量的乙醇,原因是__________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是_______;浓硫酸用量又不能过多,原因是_______。
(2)饱和Na2CO3溶液的作用是_______________。
(3)反应结束后,将试管中收集到的产品倒入分液漏斗中,______、_______,然后分液。
(4)若用b装置制备乙酸乙酯,其缺点有__________、__________。由b装置制得的乙酸乙酯产品经饱和碳酸钠溶液和饱和食盐水洗涤后,还可能含有的有机杂质是________,分离乙酸乙酯与该杂质的方法是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类的说法正确的是( )
A. 所有糖类物质都有甜味 B. 葡萄糖是人体重要的能量来源
C. 蔗糖和葡萄糖都是单糖 D. 糖类都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置可应用于实验室制氯气并回收二氯化锰的实验,能达到实验目的的是
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离出MnCl2溶液中的固体MnO2
D.用装置丁称得回收的二氯化锰质量为5.36 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组以粗镍(含少量Fe和Cr杂质)为原料制备Ni(NH3)6Cl2,并测定相关组分的含量。制备流程示意图如下:
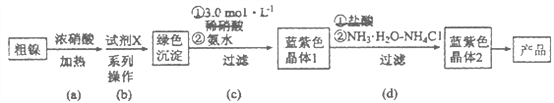
已知:①部分离子生成氢氧化物沉淀的pH(开始沉淀的pH按离子浓度为0.1 mol·L-1计算)如下表所示:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
②Ni(OH)2为绿色难溶物。Ni(NH3)6(NO3)2、Ni(NH3)6Cl2均为可溶于水的蓝紫色晶体,水溶液均显碱性。
回答下列问题:
(1)实验需要配制3.0mol·L-1稀硝酸250mL,需要的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和_________________。
(2)步骤(a)中Ni和浓硝酸反应的化学方程式为________________。
(3)步骤(b)首先加入试 剂X调节溶液的pH约为6,过滤后再继续加入X调节pH以得到绿色沉淀。
①调节pH约为6的原因是_______________________________________________。
②试剂X可以是__________________(填标号)。
A. H2SO4 B. Ni(OH)2 C. NaOH D. Fe2O3 E. NiO
(4)NH3含量的测定
i. 用电子天平称量mg产品于锥形瓶中,用25mL水溶解后加入3.00mL 6 mol/L盐酸,以甲基橙作指示剂,滴定至终点消耗0.500 0 mol·L-1NaOH标准溶液V1mL;
ii. 空白试验:不加入样品重复实验i,消耗NaOH标准溶液V2mL。
NH3的质量分数为____________。(用V1 ,V2表示)
②在上述方案的基础上,下列措施能进一步提高测定准确度的有____________(填标号)。
A. 适当提高称量产品的质量 B. 用H2SO4溶液替代盐酸
C. 用酚酞替代甲基橙 D. 进行平行实验
(5)为测定Cl-的含量,请补充完整下述实验方案。
称量mg产品于锥形瓶中,用25mL水溶解,________________,滴入2~3滴K2CrO4溶液作指示剂,用已知浓度的AgNO3标准溶液滴定至终点,记录读数,重复操作2~3次。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com