
【题目】某种利胆解痉药的有效成分是亮菌甲素,其结构简式如图所示。下列关于亮菌甲素的说法中,正确的是

A. 亮菌甲素的分子式为C12H12O5
B. 1mol亮菌甲素最多能和2molNaOH反应
C. 1mol亮菌甲素最多能和4molH2发生加成反应
D. 亮菌甲素在一定条件下可以与乙酸发生酯化反应
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是
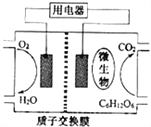
A. 该电池能够在高温下工作
B. 放电过程中,质子(H+)从正极区向负极区迁移
C. 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
D. 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014全国大纲卷】
苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是 。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L 的某二元酸H2A的溶液中可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH的变化如图所示,下列说法中不正确的是

A. H2A的电离方程式为H2A![]() HA-+H+, HA-
HA-+H+, HA-![]() H++A2-
H++A2-
B. Na2A溶液一定呈碱性,NaHA溶液一定呈酸性
C. 常温下,电离常数K(HA-)=10-3
D. W点的溶液中pH=3-lg3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,迷迭香酸的分子结构如图,下列叙述正确的是( )

A.迷迭香酸属于芳香族化合物,分子式C18H18O8
B.迷迭香酸含有碳碳双键、羟基、羧基、苯环和酯基的结构
C.1mol迷迭香酸最多能和含6mol Br2的浓溴水发生反应
D.1mol迷迭香酸最多与含5mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A. AlO2— B. Cu2+ C. Al3+ D. Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+与 Fe3+的物质的量浓度之比为3∶2。则已反应的Fe3+与未反应的Fe3+的物质的量之比是( )
A. 1∶1 B. 1∶2 C. 2∶1 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E、F、G在元素周期表中的位置如图1所示。

回答下列问题:
(1)G的基态原子核外电子排布式为___________;原子的第一电离能:D_____E(填“>”或“<”)。
(2)根据价层电子对斥理论,A2C中的“A—C—A”键角是_________(填字母序号)。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120 D.接近109°28ˊ,但小于109°28ˊ
(3)已知化合物G(BC)5的G元素化合价为0,熔点为-20℃,沸点为103℃,其固体属于_______晶体,该物质中存在的化学键类型有________,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为_________________________。
(4)化合物BCF2的分子立体构型为________,其中B原子的杂化轨道类型是_________。写出一个与BCF2具有相同空间构型的含氧酸根离子符号_____________。
(5)化合物EC的晶胞结构如图2所示。每个晶胞中含有_______个E2+。若EC晶体的密度为dg·cm-3,阿伏伽德罗常数值为NA,则晶胞参数a=_________nm(列出计算式,不要求最终结果)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。实验室用氯化钠、废铁屑、稀硫酸、氢氧化钾溶液等为原料,通过以下过程制备高铁酸钾(K2FeO4):

(l) Na2O2的电子式为__________。
(2)操作I的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、隔绝空气减压干燥.其中隔绝空气减压干燥的目的是_______。
(3)气体X为____,写出FeSO4与Na2O2反应的化学方程式:________。
(4)最终在溶液中可得到K2FeO4 晶体的原理是_________。
(5)已知K2FeO4在水溶液中可以发生:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑,,则K2FeO4 可以在水处理中的作用是__________。
4Fe(OH)3(胶体)+8OH-+3O2↑,,则K2FeO4 可以在水处理中的作用是__________。
(6)称取提纯后的K2FeO4样品0.2100g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250mL 溶液,取出25.00 mL放入锥形瓶,用0.0l000mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00mL。涉及的主要反应为:Cr(OH)4-+FeO42-=Fe(OH)3+CrO42-+OH-
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为______________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com