
| A. | 苯不能使酸性KMnO4溶液褪色,与甲烷性质相似,因此苯为饱和烃 | |
| B. | 苯的结构简式为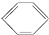 有三个双键,可与溴水发生加成反应 有三个双键,可与溴水发生加成反应 | |
| C. | 苯的6个碳原子和6个氢原子在同一平面内 | |
| D. | 将1 mL苯和1 mL水充分混合后静置,二者互溶 |
分析 A、苯属于芳香烃,为不饱和烃,与甲烷的性质不相似;
B、苯中化学键是介于单键与双键之间的一种特殊键,不含碳碳双键,不能与溴水发生加成反应;
C、苯是平面结构;
D、苯难溶于水.
解答 解:A、苯属于芳香烃,为不饱和烃,苯可以与氢气发生加成反应,可以发生取代反应,甲烷不能发生加成反应,二者性质不相似,故A错误;
B、苯中化学键是介于单键与双键之间的一种特殊键,不含碳碳双键,不能与溴水发生加成反应,故B错误;
C、苯是平面结构,苯的6个碳原子和6个氢原子在同一平面内,故C正确;
D、苯难溶于水,将1mL苯和1mL水充分混合后静置,二者分层,故D错误.故选C.
点评 本题考查苯的结构与性质,难度不大,注意苯环上碳碳键的键长相等,苯中化学键是介于单键与双键之间的一种特殊键,不存在C=C双键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠投入到水中 Na+2H2O═Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液与盐酸反应:HCO3-+H+═CO2↑+H2 O | |
| C. | 强酸与强碱反应:H++OH-═H2O | |
| D. | CaCO3与盐酸反应:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
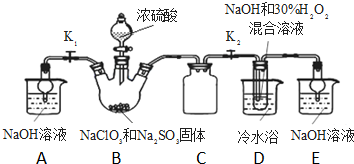 亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:
亚氯酸钠(NaClO2)是重要漂白剂.探究小组开展如下实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 | |
| C. | 硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | SO2具有漂白性 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在粗硅的制取中发生反应2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si,硅被还原,可推知碳的非金属性强于硅的非金属性 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 向某溶液中加入稀盐酸,能产生使澄清石灰水变浑浊的气体,说明该溶液中一定含有CO32- | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com