


科目:高中化学 来源: 题型:
| A、NH4+的水解反应离子方程式:NH4++H2O=NH3?H2O+H+ |
| B、在AgCl悬浊液中加入KI溶液充分振荡的离子方程式:Ag++I-=AgI↓ |
| C、镀铜时,阴极的电极反应式为:Cu2++2e-=Cu |
| D、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入烧碱溶液,微热时有气体放出,该气体能使湿润的红色石蕊试纸变蓝,则原溶液中有NH4+ |
| B、加入盐酸无现象,再加BaCl2溶液,有白色沉淀生成,则原溶液中有SO42- |
| C、加入盐酸有无色气体逸出,该气体能使澄清石灰水变浑浊,则原溶液有CO32- |
| D、加入Ba(OH)2溶液,有白色沉淀生成,则原溶液中有 SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 .
.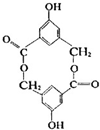 所示,
所示,查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氯化铁溶液中滴加HI溶液:2Fe3++2HI=2Fe2++2H++I2 |
| B、1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| D、将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20H-+5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com