
分析 先根据镁和稀硫酸的物质的量,判断出不足量的是镁,然后镁的物质的量,利用关系式Mg~H2SO4,计算出生成氢气的物质的量,再根据标况下气体摩尔体积22.4/mol计算出氢气体积,根据计算结果判断液体量瓶中液体的体积.
解答 解:10mL 2mol/L的硫酸溶液中,硫酸的物质的量是:0.01L×2mol/L=0.02mol,
根据电子守恒找出反应的关系:Mg~H2SO4,二者的物质的量比是1:1,0.02mol硫酸完全反应需要金属镁的质量是:0.02×24g=0.48g>0.110g,
显然硫酸过量,需要按照不足量的镁进行计算生成氢气的体积,
所以生成氢气的体积是:$\frac{0.110g}{24g/mol}$×22.4L/molL≈0.102L=102mL,
故答案为:102mL.
点评 本题考查物质的量的计算,题目难度不大,正确判断反应物过量情况为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:解答题
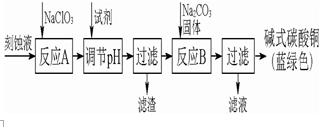 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢是铁合金,钢的含碳量低于生铁,性能优于生铁 | |
| B. | 金属具有的物理通性是延展性、导热性、银白色光泽、导电性 | |
| C. | 符号Al既能表示铝元素,又能表示一个铝原子,还能表示铝单质 | |
| D. | 焊锡是锡铅合金,把铅加入锡中制成合金的主要目的是降低熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120℃,将wg甲醛在足量空气中燃烧,将生成产物用固体Na2O2(过量)吸收,固体增重wg | |
| B. | 24gMg带在足量CO2气体中燃烧,生成固体质量为40g | |
| C. | 相同物质的量的Al、Al2O3、Al(OH)3与足量NaOH溶液反应,溶液增重相等 | |
| D. | 在Fe3O4与足量浓硝酸的反应中,参加反应的Fe3O4与体现酸性的HNO3物质的量之比为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 滤液A中阳离子为Fe2+、H+ | B. | 样品中金属Fe的质量为2.14g | ||
| C. | 样品中CuO的质量为4.0g | D. | V=448 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
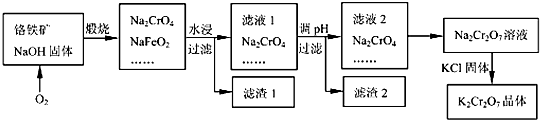
 Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.
Cr2O72-+H2O的存在,加稀硫酸增大了H+的浓度,平衡正向移动,使CrO42-浓度减小,Cr2O72-浓度增大,溶液由黄色变为橙色.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
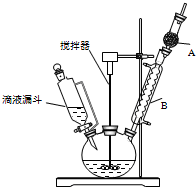 三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体.实验室合成三苯甲醇的实验装置如图所示.| 物质 | 沸点/℃ |
| 三苯甲醇 | 380 |
| 乙醚 | 34.6 |
| 溴苯 | 156.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com