
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
CO(g)+H2(g)在一体积可变的容器中进行。下列条件的改变对其化学反应速率几乎没有影响的是:①增加C的用量;②将容器体积缩小一半;③保持容器体积不变,充入氮气使容器内压强增大;④保持压强不变,充入氮气使容器的体积变大
A. ②④ B. ①③ C. ③④ D. ①④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从海水中提取镁可按如下步骤进行:①把贝壳(主要成分是碳酸钙)煅烧成生石灰;②在引有海水的渠中加入生石灰,经过沉降,然后过滤得沉淀物;③将沉淀物与稀盐酸反应,然后结晶、过滤、干燥;④电解获得产物。根据上述提取镁的全过程,没有涉及的反应类型是( )
A.分解反应B.化合反应
C.置换反应D.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,两种酸的电离平衡常数如下表,下列叙述正确的是( )
Ka1 | Ka2 | |
H2A | 1.3×10-2 | 6.3×10-6 |
H2B | 4.2×10-7 | 5.6×10-11 |
A. H2A的电离方程式:H2A 2H++A2-
B. 常温下,在水中Na2B的水解平衡常数为:![]()
C. 相同pH的Na2A、Na2B溶液中物质的量浓度:c(Na2A)>c(Na2B)
D. 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2AA2-+H2B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是主要的温室气体,也是一种工业原料。回收利用CO2有利于缓解温室效应带来的环境问题。
(1)我国科学家通过采用一种新型复合催化剂,成功实现了CO2直接加氢制取高辛烷值汽油。
已知:2H2 (g)+O2 (g) =2H2O(l) ΔH = -571.6 kJ/mol
2C8H18(l)+25O2(g) =16CO2(g)+18H2O(l) ΔH = -11036 kJ/mol
25℃、101kPa条件下,CO2与H2反应生成辛烷(以C8H18表示)和液态水的热化学方程式是_________。
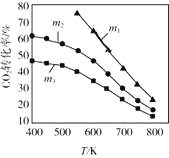
(2)CO2催化加氢合成乙醇的反应原理是:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol图是起始投料不同时,CO2的平衡转化率随温度的变化关系,m为起始时的投料比,即m=![]() 。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
。m1、m2、m3投料比从大到小的顺序为_________,理由是_________。
(3)在Cu/ZnO催化剂存在下,将CO2与H2混合可合成甲醇,同时发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
CH3OH(g)+H2O(g) ΔH1=-53.7 kJ/mol
反应Ⅱ CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
CO(g)+H2O(g) ΔH2=+41.2 kJ/mol
控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
实验序号 | T/K | 催化剂 | CO2转化率/% | 甲醇选择性/% |
实验1 | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
实验2 | 543 | Cu/ZnO纳米片 | 10.9 | 72.7 |
实验3 | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
实验4 | 553 | Cu/ZnO纳米片 | 12.0 | 71.6 |
①对比实验1和实验3可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因_______________;
②对比实验1和实验 2可发现:在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因____________。
③有利于提高CO2转化为CH3OH平衡转化率的措施有_______。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大![]() 的初始投料比
的初始投料比
(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2,电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是_____________。
②工业上生产1.4×104 kg 的LDPE,理论上需要标准状况下______L 的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________________。试写出NaHCO3溶液显碱性的的离子方程式________,
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______________。
(3)体积相同、pH相同的CH3COOH溶液和HClO溶液,与NaOH溶液中和时两者消耗NaOH的物质的量________(填字母)。
A.相同 B.中和CH3COOH的多
C.中和HClO的多 D.无法比较
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水 稀释至1 000 mL,稀释过程pH变化如图所示,则HX的电离常数 ________(填“大于”“等于”或“小于”)醋酸的电离常数。

(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______ (填写序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A ⑤A中有锌剩余 ⑥B中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是一种防止血管中血栓形成与发展的药物,其合成路线如图所示 (部分反应条件略去)。
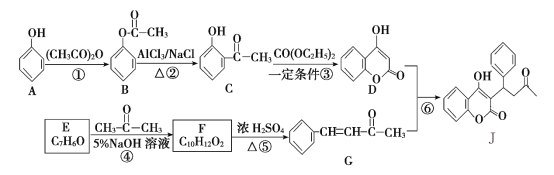
回答下列问题:
(1)反应①的反应类型是________,反应⑥的反应类型是________。
(2)J的分子式是________。F的结构简式是________。
(3)反应③的化学方程式为___________________________________。
(4)写出同时满足下列条件的F的所有同分异构体的结构简式________。
①苯环上只有两个处于对位的取代基;
②1 mol该有机物能与含2 mol NaOH的溶液恰好完全反应。
(5)参照J的合成路线,设计一种以![]() 为原料制备
为原料制备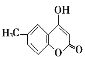 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 1 mol H2含有的分子数目为2NA
B. 0.5 mol H2SO4所含的原子总数目为0.5NA
C. 1 mol O3含有的氧原子数为2NA
D. 0.5 mol H2O含有NA个氢原子和0.5NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)![]() N2O4(g);ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图。下列说法中,正确的是
N2O4(g);ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如下图。下列说法中,正确的是

A.反应速率:v正(b点)<v正(d点)
B.前10min内用v(N2O4)表示的平均反应速率为0.04mol/(L·min)
C.25min时,导致平衡移动的原因是升高温度
D.a和c点:Qc(浓度熵)<K(平衡常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,电池反应为:4Li+FeS2=Fe+2Li2S。下列说法不正确的是
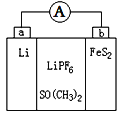
A. 该装置将化学能转化为电能
B. 可以用水代替 SO(CH3)2做溶剂
C. 电子移动方向是由a极经外电路流向b极
D. b极电极反应式是:FeS2+4Li++4e-=Fe+2Li2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com