

分析 碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾.
(1)铵明矾溶液中铝离子水解,溶液呈酸性,得到氢氧化铝胶体,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝;
(2)过程I利用溶解度不同发生复分解反应;
(3)HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀;
(4)铵明矾的溶解度随温度升高明显增大,从溶液中获得晶体,加热浓缩、冷却结晶、过滤洗涤、干燥;
(5)①夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧.实验过程中,装置A和导管中未见红棕色气体,说明没有说出氮的氧化物;试管C中的品红溶液褪色,生成了二氧化硫,在支口处可检验到NH3要注意排除二氧化硫的干扰,操作是打开K1,用蘸有浓盐酸的玻璃棒靠近支口,会出现白烟;生成了二氧化硫,T型导管中出现白色固体可能是(NH4)2SO3,还可能是氧化生成的(NH4)2SO4等;残留的两性氧化物为氧化铝,溶于NaOH溶液生成偏铝酸钠;
②根据电子转移守恒确定n(N2):n(SO2),相同条件下气体体积之比等于其物质的量之比.
解答 解:碳酸氢铵溶液中加入硫酸钠,过滤得到滤渣与溶液A,而滤渣焙烧得到碳酸钠与二氧化碳,可知滤渣为NaHCO3,过程I利用溶解度不同发生复分解反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,滤液A中含有(NH4)2SO4 及溶解的NH4HCO3,加入硫酸,调节pH使NH4HCO3转化二氧化碳与(NH4)2SO4 ,得到溶液B为(NH4)2SO4 溶液,再加入硫酸铝得铵明矾.
(1)铵明矾溶液中铝离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,溶液呈酸性;水解得到氢氧化铝胶体,可以吸附悬浮物质,可以用于净水;向溶液中加入氢氧化钠溶液,首先与溶液中铝离子反应生成氢氧化铝沉淀,再与氨气根离子反应生成氨气,再加入过量的NaOH溶液溶解氢氧化铝,现象为:先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失,
故答案为:酸性;铵明矾溶液电离出的铝离子水解生成氢氧化铝胶体,有吸附作用,故铵明矾能净水;先产生白色沉淀,后产生有刺激性气味的气体,再加入过量的NaOH溶液,白色沉淀逐渐溶解并消失;
(2)过程I利用溶解度不同发生复分解反应,反应方程式为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ,
故答案为:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4 ;
(3)省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低,
故答案为:省略过程Ⅱ,因HCO3-与Al3+的水解相互促进,产生大量氢氧化铝沉淀,导致铵明矾的产率降低;
(4)用于铵明矾的溶解度随温度升高明显增大,从溶液中获得晶体,加热浓缩、冷却结晶、过滤洗涤、干燥,
故答案为:冷却结晶;
(5)①检验氨气方法为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;
装置A和导管中未见红棕色气体,说明没有说出氮的氧化物,试管C中的品红溶液褪色,说明加热分解有SO2生成,氨气与二氧化硫、水蒸汽反应可以生成(NH4)2SO3,白色固体可能是(NH4)2SO3,还可能是氧化生成的(NH4)2SO4等;
装置A试管中残留的白色固体是两性氧化物,该物质为氧化铝,与氢氧化钠溶液反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:打开K1,用蘸有浓盐酸的玻璃棒靠近支口,出现白烟;(NH4)2SO3;Al2O3+2OH-=2AlO2-+H2O;
②根据电子转移守恒:2×[0-(-3)]×n(N2)=n(SO2)×(6-4),故n(N2):n(SO2)=1:3,相同条件下气体体积之比等于其物质的量之比,故V(N2):V(SO2)=1:3,
故答案为:1:3.
点评 本题考查制备实验方案设计、物质组成的测定,明确工艺流程原理是解题关键,综合考查学生分析解决问题的能力,难度中等.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的和操作 | 影响结果 | 原因分析 |
| A | 将2g I2加入到98mLCCl4中溶解混匀后,配制质量分数为2% I2的CCl4溶液 | 偏小 | CCl4的密度大于1g•mL-1 |
| B | 用10mL的量筒测量酯化反应得到乙酸乙酯的体积,俯视液面读出数据为6.0mL | 偏小 | 平视读取应大于6.0mL |
| C | 配制2mol•L-1NaCl溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余的水 |
| D | 用尖嘴有气泡的碱式滴定管盛标准NaOH溶液滴定20.00mL某待测HCl溶液的浓度 | 偏大 | 流出碱液的量 变大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01mol/(L•s) | B. | v(NO)=0.08mol/(L•s) | ||
| C. | v(H2O)=0.003mol/(L•s) | D. | v(NH3)=0.001mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
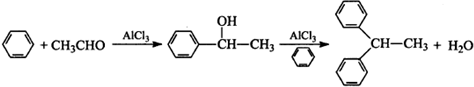

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| B. | 最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物 | |
| C. | 绿色化学反应选择的原料、催化剂、溶剂都应该是无毒无害的 | |
| D. | 乙烯分别与溴水和溴的四氯化碳溶液反应制备1,2-二溴乙烷的原子利用率均为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、W单核离子均能破坏水的电离平衡 | |
| B. | W元素氧化物对应水化物的酸性一定强于Z | |
| C. | 含X、Y、Z三种元素组成的化合物不止2种 | |
| D. | 因为X的氢化物分子间有氢键,所以X的氢化物较Z的氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 温度(℃) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| K2SO4 | 7.4 | 9.2 | 11.1 | 12.97 | 14.8 | 16.6 | 18.17 | 19.8 | 21.4 | 22.4 | 24.1 |
| Al2(SO4)3•18H2O | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 | 59.2 | 66.2 | 73.1 | 86.8 | 89.0 |
| KAl(SO4)2•12H2O | 3.0 | 4.0 | 5.9 | 8.4 | 11.7 | 17.0 | 24.8 | 40.0 | 71.0 | 109.0 | 154.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com