
分析 (1)氯气具有强氧化性,所以作氧化剂,化合价由0价变为-1价,则氨气作还原剂,化合价升高,所以氧化产物是氮气;
(2)生成1molN2时转移6mol电子,故有NA:6=a:b,据此计算阿伏伽德罗常数;
(3)当X为HCl时,NH3肯定反应完了,由方程式2NH3+3Cl2=N2+6HCl结合阿伏伽德罗定律解答;
当V为NH4Cl,Cl2肯定反应完了,由8NH3+3Cl2=N2+6NH4Cl及阿伏伽德罗定律解答.
解答 解:(1)从氮元素价态知对应反应为氧化还原反应,因Cl2有强氧化性,氨气中N元素化合价为-3价、氮气中N元素化合价为0价,故NH3是还原剂,N2是氧化产物28g•mol -1,故答案为:28g/mol;
(2)生成1molN2时转移6mol电子,故有1:6=$\frac{a}{{N}_{A}}$:b,NA=$\frac{6a}{b}$mol-1,
故答案为:$\frac{6a}{b}$mol-1;
(3)①当X为HCl时,NH3肯定反应完了,由方程式2NH3+3Cl2=N2+6HCl及阿伏加德罗定律:反应前后气体的体积之比等于物质的量之比等于系数之比,可推出V3=2V2+V1,故答案为:V3=2V2+V1;当X为HCl时,NH3肯定反应完了,由方程式2NH3+3Cl2=N2+6HCl及阿伏加德罗定律可推出V3=2V2+V1;
②当V为NH4Cl,Cl2肯定反应完了,由8NH3+3Cl2=N2+6NH4Cl阿伏加德罗定律可推出V3=V2-$\frac{7}{3}$V1,故答案为:V3=V2-$\frac{7}{3}$V1.
点评 本题考查阿伏伽德罗定律及氧化还原反应,明确常见物质的性质及阿伏伽德罗定律内涵是解本题关键,难点是阿伏伽德罗定律的灵活运用,题目难度中等.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| C. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| D. | 浓硫酸可用来干燥H2S、CO、Cl2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| B. | 石油裂化主要得到乙烯 | |
| C. | 石油分馏是化学变化,可得到汽油、煤油 | |
| D. | 煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程,属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

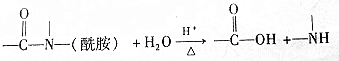
| A. | 该物质属于有机高分子 | B. | 不能发生酯化反应 | ||
| C. | 不能与氢气发生加成反应 | D. | 酸性条件下加热水解,有CO2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | $\frac{x}{100}$L | B. | $\frac{100-x}{100}$L | C. | $\frac{200-x}{200}$L | D. | $\frac{100-2x}{200}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 标准状况下,2.24LNO和2.24LO2混合气体分子数为0.15NA | |
| C. | 加热条件,1molFe投入足量的浓硫酸,生成NA个SO2分子 | |
| D. | 0.1molNa2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
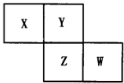 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | Z的单质与氢气反应较Y剧烈 | |
| B. | X、Y形成的化合物都易溶于水 | |
| C. | 这四种元素的单质以Z熔点最高 | |
| D. | 最高价氧化物对应水化物的酸性W比Z弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L水中溶解5.85gNaCl所形成溶液物质的量浓度是0.1mol•L-1 | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | 3.4gNH3中含N-H键数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com