
| A. | △H1>0 | B. | △H2<0 | C. | △H3<0 | D. | △H4<0 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3体积/mL | 26.90 | 26.55 | 27.00 | 26.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
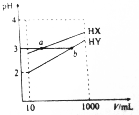 常温下,10mL浓度均为0.1mol/L的HX和HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.则下列说法正确的是( )
常温下,10mL浓度均为0.1mol/L的HX和HY两种一元酸溶液加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.则下列说法正确的是( )| A. | HX的电离常数K(HX)大于HY的电离常数K(HY) | |
| B. | a点水的电离程度大于b点水的电离程度 | |
| C. | a、b两点对应的两种酸等体积混合后溶液的pH大于混合前溶液的pH | |
| D. | 浓度均为0.1mol/L的NaX和NaY组成的混合溶液中c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

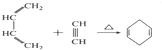
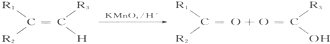
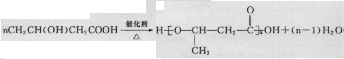
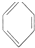 B.
B.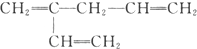 C.
C.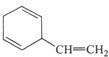 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
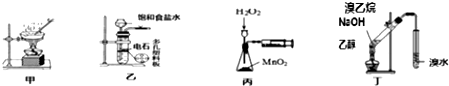
| A. | 用图甲蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| B. | 用图乙制取乙炔气体 | |
| C. | 丙装置可定量测定 H2O2的分解速率 | |
| D. | 丁可用于证明实验中生成了乙烯 |
查看答案和解析>>
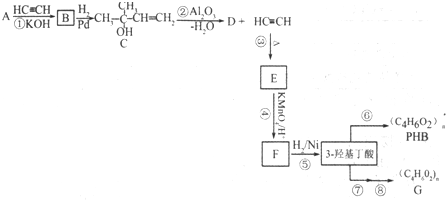
科目:高中化学 来源: 题型:选择题
| A. | C4H10O | B. | C4H4O2 | C. | C3H6O2 | D. | C4H8O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
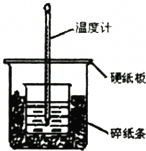 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 起始温度/℃ | 终止温度/℃ | 温度差/℃ | |||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.35 | 27.6 | 3.25 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
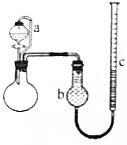 某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:
某研究性学习小组为了测定镀锌薄铁板(假设只含Fe和Zn)中锌的质量分数ω(Zn),用如图所示装置(夹持装置略去)进行实验,通过测定产生H2的体积计算ω(Zn).已知:①锌易溶于强碱溶液,发生反应为Zn+2NaOH═Na2ZnO2+H2↑.②所用的镀锌薄铁板均为m1g.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com