
(8分)
(1)表示含有20个中子的氯原子的符号为
(2)写出4核10电子分子的电子式
(3)已知一氧化碳的燃烧热 为—283kJ/mol,写出表示一氧化碳燃烧热的热化学方程式
为—283kJ/mol,写出表示一氧化碳燃烧热的热化学方程式
(4)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是 。
科目:高中化学 来源: 题型:
(8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素的名称为 ;
(2)若C→D为化合反应,则此时的化学方程式 ;
(3)写出反应④的离子方程式 ;
(4)写出反应③的电极方程式:阳极 ; 阴极 。
(5)从能量变化的角度看,①②③反应中属于△H>0的反应是_______。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)现有A、B、C、D四种溶液,它们的阳离子和阴离子均各不相同,所含阳离子是:Ba2+、Ag+、H+、Na+,所含阴离子是:CO32—、NO3—、Cl—、OH-,为了确定这四种溶液成分,进行如下化学实验:
(1)A与B混合后无现象
(2)B与D混合后产生气体
(3)B与C混合后产生沉淀
(4)A与D混合产生沉淀,该沉淀溶于B
(5)A与C混合产生沉淀
根据上述实验现象,则A、B、C、D四瓶溶液的溶质分别是(用化学式表示): 、 、 、 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市普陀区高三上学期期末质量抽测化学试卷 题型:填空题
(本题共8分)
β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)、请用氧化物的形式表示硼砂的化学式 。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(2)、(1)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于 周
期,第 族。
(2)能用于比较N与O非金属性相对强弱的事实是 。
A.最高价氧化物对应水化物的酸性 B.H2O(g) 比NH3(g)稳定
C.单质与H2反应的难易程度 D.NO中氮元素显正价,氧元素显负价
(3)、写出指定分子的电子式:生成物中含极性键的非极性分子 。
(4)、与硼同主族且相邻周期的元素,其单质与NaOH(aq)反应的离子方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年黑龙江省高三上学期期末考试化学试卷 题型:填空题
(8分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
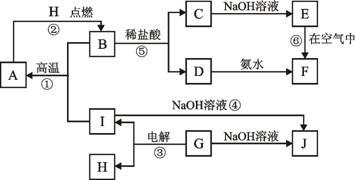
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素的名称为 ;
(2)若C→D为化合反应,则此时的化学方程式 ;
(3)写出反应④的离子方程式 ;
(4)写出反应③的电极方程式:阳极 ; 阴极 。
(5)从能量变化的角度看,①②③反应中属于△H>0的反应是_______。(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com