
| A�� | ���ʱ����Ӧÿ����1mol H+ʱ����ת�Ƶ����ʵ���Ϊ1mol | |
| B�� | �ŵ�����У�����������Һ�����Լ��� | |
| C�� | �ŵ�ʱ��������ӦΪVO2++2H++e-�TVO2++H2O | |
| D�� | ���ʱ������������Һ����ɫ��Ϊ��ɫ |
���� ���ݵ���ܷ�Ӧ�Ͳμ����ʵĻ��ϼ۵ı仯��֪���ŵ�ʱ����صĸ�������V2+����ɫ������ʧ���ӵ�������Ӧ����������VO2+����ɫ�������õ��ӵĻ�ԭ��Ӧ�����ʱ��������VO2+ʧ���ӷ���������Ӧ��Ϊ�ŵ�ʱ��������Ӧ���淴Ӧ��������V3+�����õ��ӵĻ�ԭ��Ӧ��Ϊ�ŵ�ʱ�ĸ�����Ӧ���淴Ӧ������ԭ��غ͵��صĹ���ԭ��֪ʶ���ش�
��� �⣺A�����ʱ��������������ʧ���ӵ�������Ӧ����VO2++H2O-e-=VO2++2H+����Ӧÿ����2molH+ʱ����ת��Ϊ1mol����A����
B���ŵ�����У���������������Ӧ��VO2++2H++e-=VO2++H2O�����������ӣ���Һ��pH������Լ�������B��ȷ��
C���ŵ�ʱ��������VO2+�õ��ӣ���������Ӧ����ʽΪ��VO2++2H++e-�TVO2++H2O����C��ȷ��
D�����ʱ�����������õ��ӵĻ�ԭ��Ӧ��V3++e-=V2+����Һ����ɫ��Ϊ��ɫ����D��ȷ��
��ѡA��
���� ���⿼��ԭ��صĹ���ԭ������Ŀ�ѶȲ���ע�����ԭ����е��Ӽ���Һ�����ӵĶ����ƶ����⣬����ӻ��ϼ۵ı仯�����ж�������Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
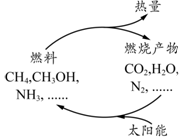 ��ͼ��ʾ�Ĺ�����Ŀǰֱ������̫���ܵ��о��ȵ㣮���ǰ�ͨ���˹��⻯ѧ�ֶκϳ�ȼ�ϵĹ��̽����˹�������ã�
��ͼ��ʾ�Ĺ�����Ŀǰֱ������̫���ܵ��о��ȵ㣮���ǰ�ͨ���˹��⻯ѧ�ֶκϳ�ȼ�ϵĹ��̽����˹�������ã�| ʱ��/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n��CH3OH��/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.7��10-5 | K1=4.3��10-7 K2=5.6��10-11 | 3.0��10-8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| �Ҵ� | 1��2-�������� | ���� | |
| ״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
| �ܶ�/g•cm3 | 0.79 | 2.2 | 0.71 |
| �е�/�� | 78��5 | 132 | 34-6 |
| �۵�/�� | -130 | 9 | -116 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol Fe��0.1 mol Cl2�г��ȼ�գ�ת�Ƶĵ�����Ϊ0.3NA | |
| B�� | 1 mol CnH2n+2�����к����ۼ���ĿΪ��3n+1��NA | |
| C�� | ��NA����ԭ�ӵ�O2�뺬NA����ԭ�ӵ�O3��������Ϊ2��3 | |
| D�� | 25��ʱ��pH=13��1.0 L Ba��OH��2��Һ�к��е�OH-��ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ǽ���Ԫ��֮��ֻ���γɹ��ۻ����� | |
| B�� | ��IA��Ԫ�صĽ�����һ����IIA��Ԫ�صĽ�����ǿ | |
| C�� | �������У�ͬ����Ԫ�ص����Ӱ뾶��������С | |
| D�� | �ǽ���Ԫ�ص���̬�⻯�ﻹԭ��Խǿ����ӦԪ�ص���ۺ���������Խ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Mg2+�Ľṹʾ��ͼ�� | |
| B�� | HClO�Ľṹʽ��H-Cl-O | |
| C�� | H2O2�ĵ���ʽ��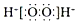 | |
| D�� | С�մ�ĵ��뷽��ʽ��NaHCO3?Na++HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1mol���������������ֱ���ȫȻ�գ�ǰ�ߡ�H�Ⱥ���С | |
| B�� | ��101kPaʱ��1mol̼ȼ�����ų�������Ϊ̼��ȼ���� | |
| C�� | ��C��s��ʯī���TC��s�����ʯ������H=+1.9kJ•mol-1 ��֪�����ʯ��ʯī�ȶ� | |
| D�� | ��Ӧ�Ⱦ��Ƿ�Ӧ�зų������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com