
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2。某小组设计了如下实验装置制备Na2S2O3(夹持及加热仪器略),总反应为2Na2S+Na2CO3+4SO2 ![]() 3Na2S2O3+CO2。回答下列问题:
3Na2S2O3+CO2。回答下列问题:

(1)装置A的作用是制备______________,反应的化学方程式为______________。
(2)完成下表实验过程:
操作步骤 | 装置C的实验现象 | 解释原因 |
检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): ① |
打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出, ② ⅱ.pH计读数逐渐 ③ | 反应分步进行: Na2CO3+SO2 2Na2S+3SO2 Na2SO3+S |
当pH计读数接近7时,立即停止通SO2,操作是 ④ | 必须立即停止通SO2的原因是: ⑤ |
(3)Na2S2O3有还原性,可作脱氯剂。向Na2S2O3溶液中通入少量Cl2,某同学预测S2O32-转变为SO42-,设计实验验证该预测:取少量反应后的溶液于试管中,______________。
【答案】(1)SO2,H2SO4+Na2SO3![]() SO2↑+H2O+Na2SO4;
SO2↑+H2O+Na2SO4;
(2)①S2-+H2O![]() HS-+OH-;②溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少);③减小;④关闭K1、K2,打开K3;⑤SO2过量会使溶液酸度增加,使产物分解,降低产率;(3)加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成。
HS-+OH-;②溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少);③减小;④关闭K1、K2,打开K3;⑤SO2过量会使溶液酸度增加,使产物分解,降低产率;(3)加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成。
【解析】
试题分析:(1)根据装置A中原料,装置A发生Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,因此制备的是SO2;(2)①装置C盛放Na2S和Na2CO3,都属于强碱弱酸盐,S2-、CO32-发生水解,题目中以S2-为例,S2-+H2O![]() HS-+OH-,溶液显碱性;②根据反应分步的方程式,除有气泡冒出外,还有淡黄色沉淀产生,溶液变浑浊,然后溶液变澄清;③消耗S2-,S2-+H2O
HS-+OH-,溶液显碱性;②根据反应分步的方程式,除有气泡冒出外,还有淡黄色沉淀产生,溶液变浑浊,然后溶液变澄清;③消耗S2-,S2-+H2O![]() HS-+OH-,使反应向逆反应方向进行,c(OH-)降低,pH减小;④立即停止通SO2,操作是关闭K1、K2,打开K3;⑤Na2S2O3在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2,如果继续通入SO2,造成溶液显酸性,Na2S2O3分解,降低产率;(3)检验SO42-:先加盐酸酸化,然后再滴加BaCl2溶液,出现白色沉淀,说明含有SO42-,因此具体操作是:加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成。
HS-+OH-,使反应向逆反应方向进行,c(OH-)降低,pH减小;④立即停止通SO2,操作是关闭K1、K2,打开K3;⑤Na2S2O3在中性或碱性环境中稳定,在酸性环境下易分解生成S和SO2,如果继续通入SO2,造成溶液显酸性,Na2S2O3分解,降低产率;(3)检验SO42-:先加盐酸酸化,然后再滴加BaCl2溶液,出现白色沉淀,说明含有SO42-,因此具体操作是:加入过量盐酸,过滤,向滤液中滴加BaCl2溶液,有白色沉淀生成。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列过程属于熵增加的是( )
A.一定条件下水由气态变为液态B.高温高压条件下使石墨转化为金刚石
C.有序排列的火柴散落D.CO点燃时生成CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各有机物的数目与分子式C4H7ClO2且能与NaHCO3溶液反应生成CO2的有机物的数目(不考虑立体异构)相同的是
A. 分子式为C5H10的烯烃 B. 甲苯的一氯代物
C. 相对分子质量为74的一元醇 D. 立方烷(![]() )的二硝基取代物
)的二硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列六种基团:①苯基 ②醛基 ③羟基 ④羧基 ⑤乙基 ⑥氯原子(-Cl)这六种基团两两结合,可形成新的化合物,写出符合下列条件的化合物的结构简式。
(1)分子内氧原子数不超过2个,具有酸性,但不能和碳酸氢钠反应________________。
(2)分子内氧原子数不超过2个,能发生银镜反应的物质,除苯甲醛和甲酰氯(Cl-CHO)外还有______________、 ____________。
(3)不稳定的两元弱酸__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一个碳原子上连有两个羟基时,易发生下列转化:![]() 。请根据下图回答:
。请根据下图回答:
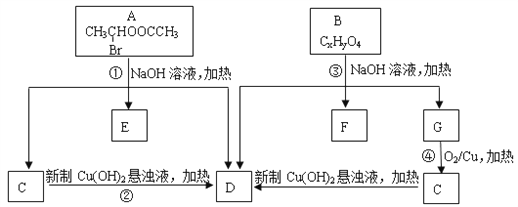
(1)A中所含官能团的名称为________________。
(2)质谱分析发现B的相对分子质量为208;红外光谱显示B分子中含有苯环结构和两个酯基;核磁共振氢谱中有五个吸收峰,其峰值比为2︰2︰2︰3︰3,其中苯环上的一氯代物只有两种。则B的结构简式为___________________。
(3)写出下列反应方程式:
①____________________________;
④_____________________________。
(4)符合下列条件的B的同分异构体共有________________种。
①属于芳香族化合物;
②含有三个取代基,其中只有一个烃基,另两个取代基相同且处于相间的位置;③能发生水解反应和银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷是氮族元素,黄砷(As4)是其一种单质,其分子结构与白磷(P4)相似,以下关于黄砷与白磷的比较叙述正确的是
A. 黄砷中共价键键能大于白磷 B. 黄砷的熔点高于白磷
C. 黄砷易溶于水 D. 分子中共价键键角均为109°28′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界里常见金属元素存在最多的是 Al,其次是铁,铜的含量较少。然而人类冶炼金属获得成功最早的反而是含量少的铜,含量最多的铝最迟冶炼出来,究其原因,合理的是
A.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发
B.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现
C.铜矿较易还原,铝矿很难还原
D.以上说法是错误的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是______________。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程中需将混合物冷却,其目的是__________________________。
(3)实验过程中,可循环使用的物质分别为_______、_______。
(4)实验中分离甲苯和苯甲醛采用的操作Ⅰ是______________,其原理是______________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com