
 .
.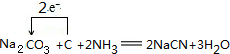 .
.
分析 (1)NaCN为离子化合物,由Na+和CN-构成,CN-中碳氮共用三对电子;
(2)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,根据化合价的变化确定电子转化方向和数目;
(3)由题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,利用元素守恒可书写化学方程式,根据电子得失守恒可计算出消耗的锌与生成的金的物质的量之比,以此来解答;
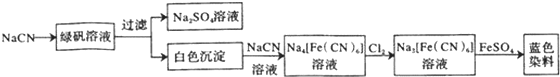
(4)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2,据此答题;
(5)根据Kh=$\frac{C(HCN)C(O{H}^{-})}{C(C{N}^{-})}$计算出水解平衡常数,比较NaCN的水解平衡常数和HCN的电离平衡常数可判断溶液的酸碱性.
解答 解:(1)NaCN为离子化合物,由Na+和CN-构成,所以电子式为Na+ ,
,
故答案为:Na+ ;
;
(2)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,反应的化学方程式,并用单线桥标明电子转移的方向和数目为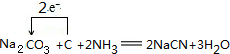 ,
,
故答案为: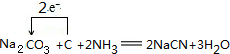 ;
;
(3)题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,O元素的化合价降低,则为氧化剂,还原1mol金要转移1mol电子,而每mol锌能转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2,
故答案为:O2;1:2;
(4)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-,Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2,
故答案为:2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-;Fe3[Fe(CN)6]2;
(5)根据Kh=$\frac{C(HCN)C(O{H}^{-})}{C(C{N}^{-})}$可知,Kh=$\frac{C(HCN)C(O{H}^{-})}{C(C{N}^{-})}$=$\frac{C(HCN)•C(O{H}^{-})•C({H}^{+})}{C(C{N}^{-})•C({H}^{+})}$=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1×1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性,
故答案为:碱;Kh=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1×1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,Kh>Ka,说明CN-的水解程度大于HCN的电离程度,混合溶液呈碱性.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意根据流程图把握实验的原理和操作方法,注意运用电子守恒进行计算,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
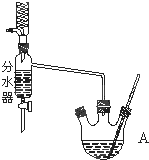 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
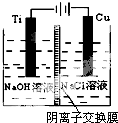 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 序号 | 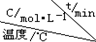 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用标准FeCl3溶液滴定KI溶液,选择KSCN溶液 | |
| B. | 用I2溶液滴定Na2SO3溶液,淀粉作指示剂 | |
| C. | 用AgNO3溶液滴定NaCl溶液,Na2CrO4作指示剂 | |
| D. | 用H2O2溶液滴定KI溶液,淀粉作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
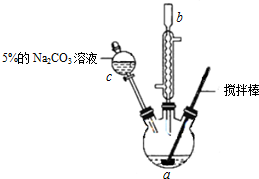
| 密度 | 沸点 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
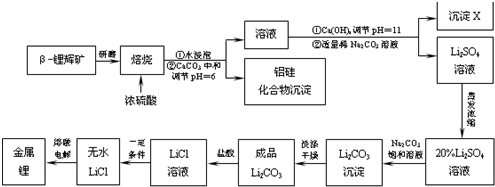
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

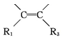 $→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+
$→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+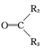
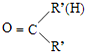 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$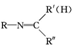 +H2O
+H2O  +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O .
.  (写出其中一种的结构简式).
(写出其中一种的结构简式).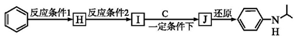 ,
, .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com