
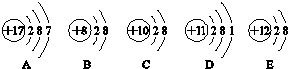
 .
.分析 A的原子序数为17,电子数与质子数相同,则A为Cl原子,B的原子序数为8,电子数为10,则B为O2-,C的质子数等于电子数,C为Ne,D的原子序数为11,质子数等于电子数,则D为Na,E的原子序数为12,电子数为10,则E为Mg2+,据此分析.
解答 解:A的原子序数为17,电子数与质子数相同,则A为Cl原子,B的原子序数为8,电子数为10,则B为O2-,C的质子数等于电子数,C为Ne,D的原子序数为11,质子数等于电子数,则D为Na,E的原子序数为12,电子数为10,则E为Mg2+,
(1)与B离子相对应的元素的符号是O2-,E为Mg2+,与E原子相对应的元素的离子结构示意图是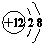 ,故答案为:O2-;
,故答案为:O2-; ;
;
(2)由原子或离子的结构示意图可知,BCE的核外均有10个电子,其中Ne为稀有气体性质最稳定,钠是活泼金属容易失去最外层一个电子,非金属元素的原子容易得电子,则最容易得到电子的是Cl,即A;
故答案为:BCE;C;D;A;
(3)活泼金属Na容易电子,活泼非金属Cl容易得电子,二者可经过得失电子后再相互结合形成的化合物NaCl,
故答案为:NaCl;
(4)B的核外有10个电子,则在核电荷数1~10的元素内,电子层结构与B电子层结构相同的离子为F-等,故答案为:F-.
点评 本题考查了原子结构与元素周期表的关系,题目难度不大,根据原子或离子正确推断各元素为解答关键,注意熟练掌握原子结构与元素性质的关系,试题培养了学生的分析能力及灵活应用能力


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )
常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )| A. | a点时,某同学用玻璃棒蘸取溶液滴在蓝色的石蕊试纸上,试纸最终变红 | |
| B. | a-b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$增大 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含12.0g NaHSO4的溶液中含氧原子数为0.4NA | |
| B. | 若铁溶于稀硝酸中,转移电子数为0.3NA,则溶解的铁一定是5.6g | |
| C. | 若0.1NA个N2分子体积为2.48L,则它的所处条件不是标准状况,质量是2.8g | |
| D. | N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,若放出46.2kJ热量,断裂H-H键数目大于1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①减小,②不变,③减小 | B. | ①增大,②不变,③减小 | ||
| C. | ①增大,②不变,③增大 | D. | ①减小,②不变,③增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减小C或D的浓度 | B. | 减小B的浓度 | C. | 增大A或B的浓度 | D. | 减小A的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com