
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴氯水 | 将铜丝放入氯化铁溶液中 |
| A. | 实验①中铁钉只做还原剂 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生的是置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
分析 ①中发生Fe+Cu2+═Fe2++Cu,②中发生3Fe2++4H++NO3-═3Fe3++NO↑+2H2O,③中发生Cu+2Fe3+═2Fe2++Cu2+,利用化合价变化判断氧化剂、还原剂,并利用氧化剂的氧化性大于氧化产物的氧化性来比较氧化性的强弱.
解答 解:A.由①中发生Fe+Cu2+═Fe2++Cu,Fe元素的化合价升高,则Fe作还原剂,故A正确;
B.3Fe2++4H++NO3-═3Fe3++NO↑+2H2O中Fe元素的化合价升高,则Fe2+只能表现还原性,故B错误;
C、置换反应是单质与化合物反应生成新单质和新化合物,而③中发生Cu+2Fe3+═2Fe2++Cu2+,生成物中没有单质,则不是置换反应,故C错误;
D、由发生的三个反应,利用氧化剂的氧化性大于氧化产物的氧化性,则上述实验证明氧化性为Fe3+>Cu2+>Fe2+,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应基本概念及应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 看反应前后是否有氧原子的得失 | |
| B. | 看反应前后是否有原子的重新组合 | |
| C. | 看反应前后是否有元素的化合价发生改变 | |
| D. | 看反应后是否有气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④除外都可以 | B. | 除②④外都可以 | C. | 只有①⑤⑥可以 | D. | 全部都可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
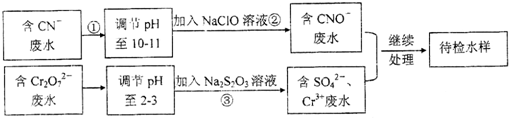
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl+AgNO3═HNO3+AgCl↓ | B. | Mg+2HCl═MgCl2+H2↑ | ||
| C. | MnO2+4HCl═MnCl2+Cl2↑+2H2O | D. | Au+HNO3+4HCl═HAuCl4+NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
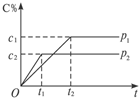 在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )
在一定温度下的可逆反应:mA(g)+nB(g)?pC(g)+qD(g),生成物C的体积分数与压强p1和p2,时间t1和t2的关系如图所示,则在下列关系中正确的是( )| A. | p1>p2 | B. | 反应吸热 | C. | m+n>p+q | D. | m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,1molC6H1206含氧原子数为6NA | |
| B. | 0.1moICl2与足量水充分混合,转移电子数为0.1NA | |
| C. | 25℃,pH=13的Ba(OH)2溶液含有OH-数目为0.2NA | |
| D. | 22.4L N2和NH3混合气体含共用电子对数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com