
| “嫦娥一号”发射火箭燃料 | 液氢(H2) | ①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)═2H2O(g)△H=-482.6kJ•mol-1 |
| 北京奥运会“祥云”火炬燃料 | 丙烷(C3H8) | ③C3H8(l)+5O2(g)═3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
| A. | 571.6 kJ•mol-1,2221.5kJ•mol-1 | B. | 241.3 kJ•mol-1,2013.8 kJ•mol-1 | ||
| C. | 285.8 kJ•mol-1,2013.8 kJ•mol-1 | D. | 285.8 kJ•mol-1,2221.5 kJ•mol-1 |
分析 依据燃烧热概念分析,1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,结合热化学方程式分析判断和计算燃烧热进行判断.
解答 解:①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 ,热化学方程式是2mol氢气燃烧生成稳定氧化物的反应,燃烧热为285.8kJ•mol-1,
②2H2(l)+O2(l)=2H2O(g)△H=-482.6kJ•mol-1,热化学方程式生成的是气体水,不是稳定氧化物,不能据此计算;
③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1,反应生成的水是气体,不是稳定氧化物,不能据此计算;
④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1,是1mol丙烷完全燃烧生成稳定氧化物放热为燃烧热即为2221.5kJ•mol-1;
根据分析可知,氢气和丙烷的燃烧热分别是:285.8kJ•mol-1,2221.5 kJ•mol-1,
故选D.
点评 本题考查热化学方程式,题目难度不大,明确燃烧热的概念为解答关键,注意掌握热化学方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ④⑥⑧ | C. | ①②④⑤ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.72L | B. | 5.6L | C. | 2.8L | D. | 13.44L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
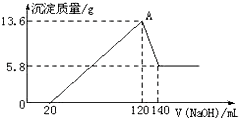 将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:(不要求写出计算过程)
将一定质量的Mg-Al合金投入100mL一定物质的量浓度的某HCl溶液中,充分反应.向反应后的溶液中逐滴加入一定物质的量浓度的NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积关系如图.回答下列问题:(不要求写出计算过程)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释后溶液的pH=9 | |
| B. | 稀释过程中,溶液中所有离子的浓度均减小 | |
| C. | 稀释后溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}.{H}_{2}O)}$减小 | |
| D. | 该氨水稀释前后中和盐酸的能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
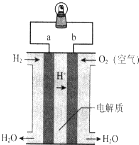
| A. | a电极是正极 | B. | 电流由b通过灯泡流向a | ||
| C. | 该电池总反应是2H2+O2═2H2O | D. | 该装置可将化学能转化为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com