
下列实验操作不能达到目的的是( )
A.除去MgCl2酸性溶液中的Fe3+:加热搅拌,加入MgCO3,过滤,加适量的盐酸
B.制备硅酸胶体:向硅酸钠水溶液中逐滴滴加稀盐酸至溶液呈强酸性
C.检验Fe2(SO4)3溶液中是否含有FeSO4:滴加少许酸性高锰酸钾溶液,并振荡
D.使盛有少量氢氧化镁沉淀的试管中的沉淀溶解:加入一定量的氯化铵溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列实验方案不能成功的是( )
A通过测浓度均为0.01 mol·L-1的溶液的pH大小来鉴别盐酸和乙酸
B向均含石蕊的盐酸和乙酸溶液中分别加入NaCl、CH3COONa来鉴别盐酸和乙酸是否为弱电解质
C加热蒸发FeCl3溶液制备FeCl3晶体
D测浓度均为0.1 mol·L-1的NaCl、CH3COONa溶液的pH来鉴别盐酸和乙酸是否为弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H2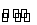 2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反
2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反 应已达到平衡状态的是( )
应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属腐蚀与防护的说法正确的是( )
A.金属腐蚀就是金属失去电子被还原的过程
B.铝制品的耐腐蚀性强,说明铝的化学性质不活泼
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.钢铁锈蚀时,铁原子失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物
查看答案和解析>>
科目:高中化学 来源: 题型:
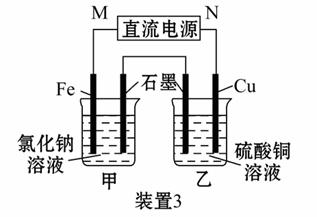
如图所示3套实验装置,分别回答下列问题:
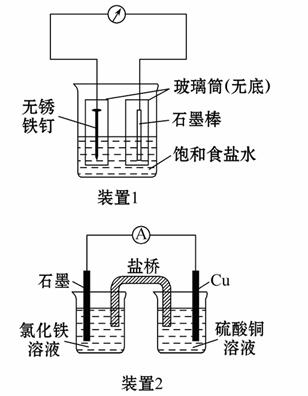
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KS CN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
CN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为___________________________________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为____________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
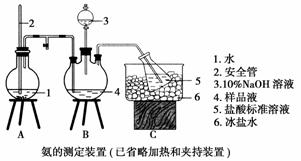
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是________________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是__________________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO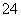 )为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为163,钴的化合价为________。制备X的化学方程式为________________________;X的制备过程中温度不能过高的原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是( )
A.工业上可用电解法制备Mg:MgCl2 Mg+Cl2↑
Mg+Cl2↑
B.自然界中正常的雨水呈酸性:H2O+CO2H2CO3H++HCO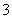
C.石膏粉CaSO4治理盐碱地(含较多可溶性的碳酸盐):
CaSO4(s)+CO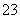 (aq)CaCO3(s)+SO
(aq)CaCO3(s)+SO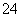 (aq)
(aq)
D.用FeSO4除去酸性废水中的Cr2O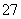 :Cr2O
:Cr2O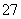 +Fe2++14H+===2Cr3++Fe3++7H2O
+Fe2++14H+===2Cr3++Fe3++7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com