
分析 (1)将等体积等浓度的AgNO3溶液和NaCl溶液混合,反应生成AgCl白色沉淀,存在的沉淀溶解平衡为AgCl(g)?Ag+(aq)+Cl-(aq);
(2)由步骤Ⅱ的浑浊Ag2S可知,滤液X中除了含有Na+、NO3-,还含有Ag+、Cl-离子;
(3)该温度下,Ag2S比AgCl溶解度更小,故氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq);
(4)在白色沉淀AgCl中,存在平衡:AgCl(g)?Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
(5)A、在步骤Ⅳ之后,继续滴加浓硝酸后,硝酸与氨水中和,生成Ag+,平衡左移,又有AgCl沉淀生成,故A正确;
B、由步骤Ⅳ可以推测:氨水可以结合Ag+,不能与Ag反应,实验室可不用氨水洗涤银镜反应后的试管,故B错误;
C、若在白色沉淀AgCl中滴加NaOH溶液,不发生反应.
解答 解:(1)将等体积等浓度的AgNO3溶液和NaCl溶液混合,反应生成AgCl白色沉淀,存在的沉淀溶解平衡为AgCl(g)?Ag+(aq)+Cl-(aq);
故答案为:AgCl(g)?Ag+(aq)+Cl-(aq);
(2)由步骤Ⅱ的浑浊Ag2S可知,滤液X中除了含有Na+、NO3-,还含有Ag+、Cl-离子;
故答案为:Ag+、Cl-;
(3)该温度下,Ag2S比AgCl溶解度更小,故氯化银转化成硫化银的反应为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq);
故答案为:2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq);该温度下,Ag2S比AgCl溶解度更小;
(4)在白色沉淀AgCl中,存在平衡:AgCl(g)?Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解,
故答案为:AgCl(g)?Ag+(aq)+Cl-(aq),银离子与氨水结合,降低了溶液中银离子的浓度,使上述平衡正向移动,促使AgCl溶解;
(5)A、在步骤Ⅳ之后,继续滴加浓硝酸后,硝酸与氨水中和,生成Ag+,平衡左移,又有AgCl沉淀生成,故A正确;
B、由步骤Ⅳ可以推测:氨水可以结合Ag+,不能与Ag反应,实验室可不用氨水洗涤银镜反应后的试管,故B错误;
C、若在白色沉淀AgCl中滴加NaOH溶液,不发生反应,沉淀不能溶解,故C错误;
故答案为:BC.
点评 本题考查了性质实验方案的设计,题目难度较中等,涉及难溶物溶度积的计算、氧化还原反应的配平、性质实验方案评价等知识,根据实验现象得出正确结论为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:推断题
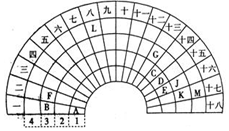 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实或现象 | 结论 |
| A | 某钾盐中滴加盐酸,产生使澄清石灰水变浑浊的无色气体 | 该钾盐是K2CO3或KHCO3 |
| B | 由淀粉得到葡萄糖 | 发生了水解反应 |
| C | 常温下,向相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中的铝片先溶解完 | 反应物的浓度越大,反应速率越快 |
| D | NH3沸点低于PH3 | 结构和组成相似的物质,沸点随相对分子质量增大而升高 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
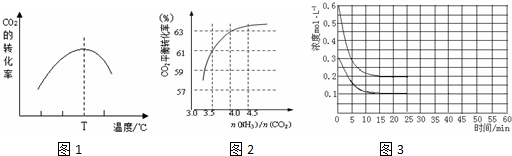
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加活性炭吸附水中小顆粒物,净化水质的方法属于物理方法 | |
| B. | 医用消毒洒精中乙醇的浓度为95% | |
| C. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝“是指硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
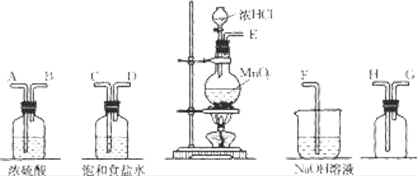
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com