
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
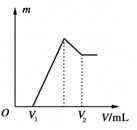
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
【答案】(10分,每空2分)(1) 0.06 0.04 440(2) 400 (3)![]() ≤a<1
≤a<1
【解析】
试题(1)在V1前没有沉淀生成,是因为H2SO4溶液过量,发生了酸碱中和反应,根据H++OH-═H2O,溶液中剩余的n(H+)=0.16L×1mol/L=0.16mol,与镁、铝的H+的物质的量为:0.1L×2 mol/L×2-0.16mol =0.24mol,设镁、铝的物质的量分别为xmol、ymol,根据Mg + 2H+═Mg2++H2↑、2Al +6H+═Al3++3H2↑,
则有:x+y=0.1 2x +3y=0.24 得:x=0.06mol、y=0.04mol;Mg2++2OH- ═Mg(OH)2↓、Al3++4OH- ═AlO2-+2H2O,所以要将0.06molMg2+和0.04molAl3+完全反应需要的OH-的物质的量为:0.06×2+0.04×4=0.28mol,V(NaOH)=0.28mol/1 mol/L="0.28L=280" mL,V2="160+280=440" mL。(2)使Mg2+、Al3+刚好沉淀完全,则溶液溶质为Na2SO4,n(NaOH)= n(H+)=0.1L×2 mol/L×2=0.4mol,V(NaOH)=0.4mol÷1 mol/L="0.4L=400" mL。(3)沉淀中无Al(OH)3,则NaOH溶液要过量,最后所得溶液中的溶质为:Na2SO4,NaAlO2,可能还会有过量的NaOH,那么n(Na+)=n(NaOH)=0.45L×2 mol/L≥0.1L×2 mol/L×2+0.1×(1-a),得:0.5≤a<1


科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)下列物质能导电且属于电解质的是________(填序号)。
A. 固态氯化镁(MgCl2) B. 液态氯化镁(MgCl2)
C. 氯化钠溶液D. 铝
(2)写出下列物质在水溶液中的电离方程式:
①Na2CO3______________;
②H2SO4______________;
③KHSO4_____________。
(3)有人说可将无机化合物KHSO4与NaHCO3归为同一类别,你认为他的理由主要是_____;有人说可将无机化合物KHSO4与H2SO4归为同一类别,你认为他的理由主要是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于恒定容积的密闭容器中进行的反应A(s)+B(g)![]() 2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
A. 加入少量A物质,平衡正向移动,正反应速率加快
B. 加入少量B物质,平衡正向移动,逆反应速率减小
C. 充入氩气(不参加反应),平衡逆向移动,逆反应速率加快
D. 升高温度,平衡逆向移动,正反应速率和逆反应速率都加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。氰化钠同时也是一种剧毒物质,严重危害人类健康,一旦泄露需要及时处理。
(1)已知25℃时,相同物质的量浓度的NaHCO3、NaCN、Na2CO3溶液pH依次增大,则向NaCN溶液中通入少量CO2,发生反应的离子方程式是________。
(2)若氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
①常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式 _____________;
②已知:氰化钠与硫代硫酸钠的反应是NaCN+Na2S2O3=NaSCN+Na2SO3,当1.96gNaCN完全反应时转移的电子物质的量是__________;实验室中硫氰化钠可以代替硫氰化钾检验______________。
(3)现要检测某经过处理过的废水中氰化钠的含量。已知:废水中氰化钠最高排放标准是0.50mg/L;Ag++2CN—=[Ag(CN)2]—(无色溶液),Ag++I—=AgI↓,CN—优先与Ag+反应。
实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂;用1.00×10—4mol·L—1的标准AgNO3溶液滴定,达到滴定终点时,消耗AgNO3溶液的体积为1.50mL。(假设废水中没有其它成分参与反应。)
①滴定达到终点时的现象是____________________________________;
②该废水________(填“能”或“不能”)直接排放到河流中,通过计算结果说明得出上述结论的依据:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)有以下10种物质:①液态氯化氢、②CCl4、③液氯、④硫酸铵晶体、⑤铁、⑥稀硫酸、⑦澄清石灰水、⑧二氧化硫,⑨熔融的硫酸钠、⑩Na2O固体。其中属于电解质的是_______(填序号,下同),属于非电解质的是_________,在现状态下能导电的是__________,写出④在水溶液中电离的方程式__________。
(Ⅱ)A、B、C是三种元素的原子,质子数都小于18。A原子与B原子的最外层电子数都是6,A原子与C原子的核外电子层数都为3, C原子的质子数比A少4。回答下列问题:
(1)C的离子结构示意图为_________;
(2)元素A的一种质量数为32的核素,与元素B的一种核素构成微粒为AB42-,1mol AB42-的质量为104g,则元素B的该核素中的中子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中能大量共存的一组离子是( )
A.NH4+、Ba2+、Brˉ、CO32ˉ
B.Clˉ、NO3ˉ、Fe2+、H+
C.K+、Na+、SO42ˉ、MnO4ˉ
D.Na+、H+、SO42ˉ、HCO3ˉ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,22.4LHCl气体溶于50mL水再配成250mL溶液:
(1)求所得盐酸的物质的量浓度_____
(2)若将此溶液再稀释成1L溶液,求稀释后盐酸的物质的量浓度_____
(3)将(2)的溶液取出500mL与足量的Zn反应可以产生多少体积的H2(在标准状况下)_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com