
| 选项 | 实验操作 | 现象 | 结论 |
| A | 溶液中加入盐酸,再滴加BaCl2溶液 | 先无现象,后产生白色沉淀 | 原溶液中有SO42- |
| B | 向两份蛋白质溶液中分别滴加饱和Na2SO4溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| C | 将Mg、Al与NaOH溶液组成原电池 | Mg电极溶解 | Mg比Al金属活动性强 |
| D | 向稀HNO3溶液中加入过量铁粉充分反应后,滴入KSCN溶液 | 溶液变为血红色 | 和HNO3具有氧化性,能将Fe氧化成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.先加入盐酸,可排除阴离子的干扰;
B.蛋白质与Na2SO4溶液发生盐析;
C.将Mg、Al与NaOH溶液组成原电池,铝为负极;
D.向稀HNO3溶液中加入过量铁粉充分反应生成Fe2+.
解答 解:A.先加入盐酸,可排除阴离子的干扰,再加入氯化钡生成沉淀,可证明原溶液中有SO42-,故A正确;
B.蛋白质与Na2SO4溶液发生盐析,硫酸铜溶液可使蛋白质变性,故B错误;
C.将Mg、Al与NaOH溶液组成原电池,铝为负极,铝溶解,故C错误;
D.向稀HNO3溶液中加入过量铁粉充分反应生成Fe2+,滴入KSCN溶液,溶液不变为血红色,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的检验以及元素化合物知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度大不,注意把握实验操作的原理和实验方法.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 某温度下,0.1mol•L-1的醋酸溶液PH=3,则其电离常数Ka≈1.0×10-4 | |
| B. | Ka、Kb、Kh均随温度升高而增大 | |
| C. | 弱酸HA的电离平衡常数为Ka,则A-的水解平衡常数为Kh=Ka•Kw | |
| D. | 因为Ksp(AgCl)<Ksp(AgOH),所以AgCl不溶于稀硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30gNO含有的原子数目为NA | |
| B. | 常温常压下,22.4LH2含有的分子数目为NA | |
| C. | 5.6g铁与足量氯气完全反应失去的电子数目为0.2NA | |
| D. | 1L1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag是还原剂 | B. | O2被还原 | C. | H2S发生氧化反应 | D. | Ag2S是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | 甲 | 乙 | 丙 |
| A | NaHCO3 | HCl | Ca(OH)2 |
| B | O2 | SO2 | NaOH |
| C | NH3 | NO2 | H2O |
| D | H2SO4(浓) | Fe | S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
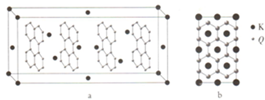
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
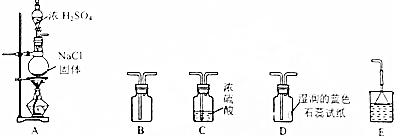
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
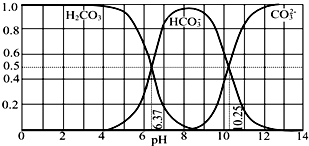
| A. | pH=10.25时,c(Na+)═c(CO32-)+c(HCO3-) | |
| B. | 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 | |
| C. | 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 | |
| D. | 若是0.1mol NaOH 反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com