【答案】
分析:A、越易电离的酸,其酸根离子越难水解.
B、0.4mol/LHB溶液和0.2mol/LNaOH溶液等体积混合后发生反应,则实质上是0.1mol/LHB溶液和0.1mol/L NaB溶液,该溶液显酸性,然后利用电荷守恒及物料守恒等来分析离子浓度的关系.
C、不同种溶液中离子浓度大小比较的一般方法:先看电离,电离的多,浓度大,电离的量相同时,再看水解程度的大小.
D、根据“电解出什么物质加入什么物质的方法”判断析出的物质,根据析出的物质与转移电子的关系式计算转移电子数.
解答:解:A、相同温度下,HF比HCN易电离,所以CN
-比F
-易水解,导致NaF溶液的PH比NaCN溶液的PH小,故A错误.
B、混合后为0.1mol/LHB溶液和0.1mol/L NaB溶液,溶液的PH=3,溶液呈酸性,所以酸的电离大于盐的水解,则c(B
-)>c(HB),钠离子是0.1mol/L,则c(B
-)>c(Na
+)>c(HB),溶液呈酸性说明溶液中c(H
+)>c(OH
-),但溶液中的氢离子和氢氧根离子浓度都较小,小于酸的浓度,所以离子浓度大小顺序是c(B
-)>c(Na
+)>c(HB)>c(H
+)>c(OH
-) 故B错误;
C、0.1mol/L的下列溶液①NH
4Al(SO
4)
2、②NH
4Cl、③NH
3?H
2O、④CH
3COONH
4溶液中,①中铝离子和铵根离子相互抑制水解,④中醋酸根离子和铵根离子相互促进水解,氨水是弱电解质电离度较小,小于盐的电离,所以c(NH
4+)由大到小的顺序是:①>②>④>③,故C错误.
D、加入0.1molCu(OH)
2才可以恢复至原来的浓度和体积,氢氧化铜相当于CuO.H
2O,所以相对于向电解后的溶液中加入氧化铜和水,即电解析出的物质是氧化铜和水.0.1molCu(OH)
2相当于0.1molCuO和0.1molH
2O.
所以电解方程式为:2H
2O+?2CuSO
4
2Cu+O
2↑+2H
2SO
4 转移电子
2mol 4mol
0.1mol 0.2mol
?2H
2O

2H
2↑+O
2↑?转移电子?
2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4 mol.故D正确.
故选D.
点评:本题考查了溶液中离子浓度的相对大小、电解原理的有关计算、盐类的水解等知识点,难度较大,易错选项是B,明确混合后溶液的溶质是解B的关键,并注意一般酸与盐的混合溶液中溶液显酸性来解答即可,学会合理应用电荷守恒及物料守恒来解题.

 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子 2H2↑+O2↑?转移电子?
2H2↑+O2↑?转移电子?


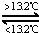 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,