
| A.100mL的盐酸中HCl物质的量浓度为7.5mol/L |
| B.生成的H2S气体在标准状况下的体积为2.24L |
| C.该磁黄铁矿中FexS的x=0.85 |
| D.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1 |


科目:高中化学 来源:不详 题型:填空题

 Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2.6 mol·L-1 |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②④ | C.①④ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原混合物中铜和铁各0.15 mol |
| B.稀硝酸的物质的量浓度为1 mol/L |
| C.第一次剩余的9.6 g金属为铜和铁 |
| D.再加入上述200 mL稀硝酸,还能得到标准状况下2.24 L NO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.气体A为二氧化硫和氢气的混合物 |
| B.气体A中二氧化硫和氢气的体积比为4:1 |
| C.反应中共消耗锌95.5g |
| D.反应中共转移电子1.5mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
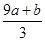 ) mol
) mol| A.①④ | B.②③ | C.①③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com