
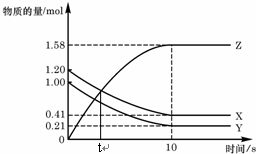
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )| A. | t秒时该反应达到化学平衡状态 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?2Z(g) |
分析 由图可知,10s物质的量不再变化达到平衡状态,X、Y的物质的量减少,Z的物质的量增加,则X、Y为反应物,Z为生成物,X、Y、Z的△n之比为(1.20-0.41):(1.00-0.21):(1.58-0)=1:1:2,则反应为X(g)+Y(g)?2Z(g),结合转化率=$\frac{转化的量}{开始的量}$×100%,以此来解答.
解答 解:由图可知,10s物质的量不再变化达到平衡状态,X、Y的物质的量减少,Z的物质的量增加,则X、Y为反应物,Z为生成物,X、Y、Z的△n之比为(1.20-0.41):(1.00-0.21):(1.58-0)=1:1:2,则反应为X(g)+Y(g)?2Z(g),
A.ts时X、Y的物质的量仍在减少,向正反应方向移动,故A错误;
B.反应开始到10 s,X的物质的量浓度减少了$\frac{(1.20-0.41)mol}{2L}$=0.395mol/L,故B错误;
C.反应开始到10s时,Y的转化率为$\frac{1.00-0.21}{1.00}$×100%=79.0%,故C正确;
D.由上述分析可知,反应的化学方程式为:X(g)+Y(g)?2Z(g),故D正确;
故选CD.
点评 本题考查化学平衡的计算,为高频考点,把握物质的量与时间的变化曲线、转化率和浓度的计算为解答的关键,侧重分析与计算能力的考查,注意图象分析及反应判断,题目难度不大.


科目:高中化学 来源: 题型:推断题
 硫酸工业的生产工艺流程可简略表示如下:
硫酸工业的生产工艺流程可简略表示如下: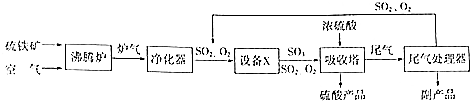 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
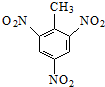 的系统命名:2,4,6-三硝基甲苯;
的系统命名:2,4,6-三硝基甲苯;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.0001mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
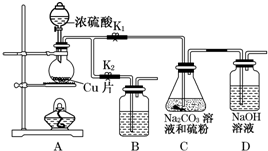
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
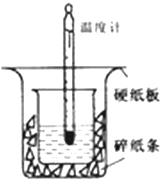 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 28.6% | C. | 15% | D. | 20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com