
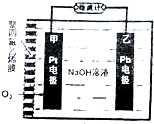
 氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )
氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变,一段时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg.下列说法正确的是( )| A. | Pt电极上发生氧化反应 | |
| B. | Pt上发生的电极反应式为4OH--4e-═O2↑+2H2O | |
| C. | 反应过程中转移OH-的物质的量为0.25bmol | |
| D. | 待测气体中氧气的体积分数为0.7$\frac{b}{a}$ |
分析 通入氧气的一极为正极,得电子发生还原反应,电极方程式为O2+2H2O-+4e-═4OH-,Pb电极为负极,失去电子发生氧化反应,电极方程式为2Pb+4OH--4e-═2PbO+2H2O,根据电极方程式和增重的质量计算转移氢氧根离子的数目及氧气的量,从而计算氧气的体积分数.
解答 解:根据装置图分析可知,该池为原电池,通入氧气的一极为正极,Pb电极为负极,
A.Pt电极通氧气,为正极,发生还原反应,故A错误;
B.通入氧气的一极为正极,得电子发生还原反应,电极方程式为O2+2H2O-+4e-═4OH-,故B错误;
C.Pb电极为负极,失去电子发生氧化反应,电极方程式为2Pb+4OH--4e-═2PbO+2H2O,结合4mol氢氧根离子,电极质量增重32g,该电极增重的质量为bg,则转移OH-的物质的量为0.125bmol,故C错误;
D.根据C的分析可知,转移电子物质的量为0.125bmol,由电极方程式为O2+2H2O-+4e-═4OH-,消耗氧气的体积为$\frac{22.4×0.125b}{4}L$=0.7bL,故氧气的体积分数为$\frac{0.7b}{a}$,故D正确.
故选D.
点评 本题考查原电池知识,注意把握原电池的工作原理,本题解答的关键是根据得失电子确定电源的两极和反应方程式,根据得失电子数目相等进行计算,注意体会答题思路,难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题:
Q、R、X、Y、Z、L六种元素的原子序数依次增大,R和L是同主族元素,R的最外层电子数比次外层电子数少1,L的单质常温常压下是紫黑色固体,Q和X形成的离子化合物XQ是碱石灰的主要成分,X、Y、Z位于同一周期,Y的外围电子数是最外层电子的6倍,Z位于ds区且不能和稀硫酸反应生成H2,请问答下列问题: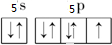 ,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;
,L的含氧酸HLO3中L的杂化方式为sp3,酸根LO3-的离子构型为三角锥形;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有一种蓝色晶体【可表示为MxFey(CN)6】,经射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,其晶体中阴离子的最小结构单元如图所示,下列说法正确的是( )
有一种蓝色晶体【可表示为MxFey(CN)6】,经射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上,其晶体中阴离子的最小结构单元如图所示,下列说法正确的是( )| A. | 该晶体的化学式为M2Fe2(CN)6 | |
| B. | 该晶体属于离子晶体,M呈+1价 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为3个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制备较弱酸 | 硫化氢通入硫酸铜溶液中不反应 |
| B | 压强越大,反应速率越快 | 加压,该反应2NH3?N2+3H2的正反应速率加快 |
| C | 金属性较强的金属为原电池的负极 | 铁、铜和浓硝酸形成的原电池,铁为负极 |
| D | 主族元素的最高正化合价等于主族的序数 | 氧的最高正化合价是+6 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)相等的NH4Cl溶液中的c(Cl-)大于(NH4)2Fe(SO4)2溶液中c(SO42-) | |
| B. | 常温下,pH=1的醋酸与pH=13的NaOH 溶液混合后的溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol•L-1的Na2CO3和NaHCO3混合溶液中 2c(Na+)═3c(CO32-)+3c(HCO3-) | |
| D. | 稀释氯化铵溶液过程中,NH4+的水解程度和水的电离程度都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能起催化剂的作用 | B. | 受热分解能放出气体 | ||
| C. | 具有净水剂的作用 | D. | 在水中能起到酸的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com