


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省成都市高三12月阶段测试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.0.01mol/L的Na2HPO4溶液中存在如下的平衡:HPO42-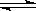 H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小
H++PO43-,加水稀释,使溶液中的HPO42-、H+、PO43-的浓度均减小
B.饱和NH4Cl溶液中:c(H+)+c(Cl-)=c(NH4+)+2c(NH3•H2O)+c(OH-)
C.常温下,0.01mol/L的 HA和BOH两种溶液,其pH值分别为3和12,将两溶液等体积混和后,所得溶液的pH≦7
D.在NH4HSO3溶液中,c(NH4+)= c(SO32-)+ c(HSO3-)+ c(H2SO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com