
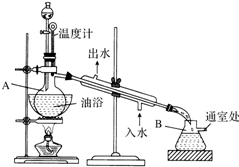
 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:分析 (1)乙酸和乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯;
(2)乙醇过量可促进乙酸的转化,边加料,边加热蒸馏,分离出乙酸乙酯,利用平衡正向移动;
(3)饱和碳酸钠溶液吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;用NaOH浓溶液代替Na2CO3,乙酸乙酯发生水解;
(4)饱和CaCl2溶液洗涤粗酯,可吸收乙醇,与乙酸乙酯分层;
(5)保持蒸馏烧瓶中压强一定,得到平稳的蒸气气流;
(6)无水硫酸钠具有吸水性.
解答 解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)用过量乙醇的主要目的是增大反应物乙醇的浓度,有利于反应向生成乙酸乙酯的方向进行,边加料,边加热蒸馏的目的是减小生成物乙酸乙酯的浓度,有利于反应向酯化方向进行,
故答案为:增大反应物乙醇的浓度,有利于反应向生成乙酸乙酯的方向进行;减小生成物乙酸乙酯的浓度,有利于反应向酯化方向进行;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;乙酸乙酯在强碱性条件下发生水解反应,
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度;致使乙酸乙酯水解;
(4)饱和CaCl2溶液可以吸收乙酸乙酯中可能残留的乙醇,这样分离出的粗酯中只含有水了,
故答案为:除去粗酯中的乙醇;
(5)加料与馏出的速度大致相等,可让产生的乙酸乙酯及时蒸馏出来,保持蒸馏烧瓶中压强一定,得到平稳的蒸气气流,
故答案为:使反应充分且能够及时冷凝蒸出产物;
(6)加入无水硫酸钠,其目的是除去粗产品中的水,
故答案为:除去粗产品中的水.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、混合物分离提纯、化学平衡移动为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
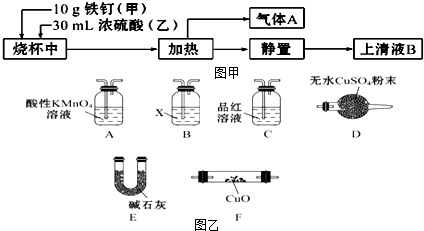
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
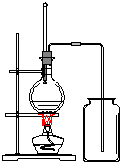 实验室是用乙醇在浓硫酸和170℃条件下制取乙烯的.
实验室是用乙醇在浓硫酸和170℃条件下制取乙烯的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 氨碱法 | 联合制碱法 |
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 可能的副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
| D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
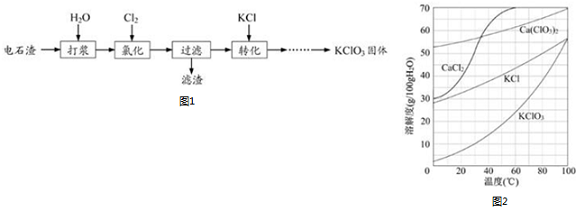
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
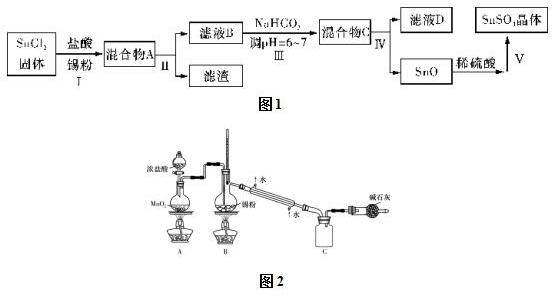
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻古(冰毒片剂) | B. | K粉(氯胺酮) | C. | 大麻(四氢大麻酚) | D. | 抗酸药 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com