
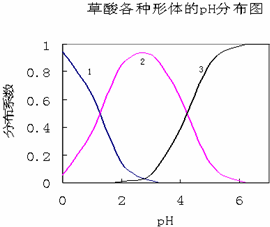
 草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:分析 根据图片知,随着pH的增大,曲线1逐渐减小,说明其电离程度增大,为草酸;
曲线2随着pH的增大而增大,应该是HC2O4-;
(1)草酸钠是强碱弱酸盐,草酸根离子水解导致溶液呈碱性,钠离子不水解;
(2)任何导致溶液中都存在电荷守恒,根据电荷守恒判断溶液酸碱性;草酸钠溶液呈碱性,要使溶液呈中性,氢氧化钠应该稍微过量;
(3)A.NaHC2O4溶液显酸性,说明草酸氢根离子电离程度大于水解程度;
B.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
(4)①Na2C2O4中草酸根离子第二步水解程度较小;
②NaHC2O4溶液呈酸性,草酸氢根离子电离程度大于水解程度;
③H2C2O4属于弱酸,电离程度较小;
④(NH4)2C2O4属于弱酸弱碱盐,草酸根离子和铵根离子相互促进水解;
⑤NH4HC2O4中草酸氢根离子和铵根离子相互促进水解;
(5)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+3价,转移电子数为10,根据转移电子相等、原子守恒、电荷守恒配平方程式;根据物质之间的关系式进行计算.
解答 解:根据图片知,随着pH的增大,曲线1逐渐减小,说明其电离程度增大,为草酸;
曲线2随着pH的增大而增大,应该是HC2O4-;
故答案为:H2C2O4;HC2O4-;
(1)草酸钠是强碱弱酸盐,草酸根离子水解导致溶液呈碱性,钠离子不水解,所以c(Na+)/c(C2O42-)>2,水解方程式为C2O42-+H2O?HC2O4-+OH-,故答案为:>;C2O42-+H2O?HC2O4-+OH-;
(2)任何导致溶液中都存在电荷守恒,根据电荷守恒c(Na+)+c(OH-)=c(H+)+2c(C2O42-)+c(HC2O4-),所以得c(OH-)=c(H+),溶液呈中性;
草酸氢钠溶液呈酸性,要使溶液呈中性,氢氧化钠应该稍微过量,所以V(NaOH)>10mL,
故答案为:中;>;
(3)A.NaHC2O4溶液显酸性,说明草酸氢根离子电离程度大于水解程度,所以溶液②中,c(C2O42-)>c(H2C2O4),故错误;
B.根据电荷守恒得c(Na+)+c(OH-)=c(H+)+2c(C2O42-)+c(HC2O4-)、根据物料守恒得c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),所以得c(H2C2O4)+c(OH-)=c(H+)+c(C2O42-)+c(HC2O4-),
故错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故正确;
D.任何电解质溶液中都存在物料守恒,根据物料守恒得c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol•L-1,故正确;
故选CD;
(4)①Na2C2O4中草酸根离子第二步水解程度较小,第二步水解程度小于②;
②NaHC2O4溶液呈酸性,草酸氢根离子电离程度大于水解程度;
③H2C2O4属于弱酸,电离程度较小,主要以草酸分子存在;
④(NH4)2C2O4属于弱酸弱碱盐,草酸根离子和铵根离子相互促进水解;
⑤NH4HC2O4中草酸氢根离子和铵根离子相互促进水解但水解程度大于④;
所以溶液中c(H2C2O4)由大到小排列的顺序是③>⑤>②>④>①,故答案为:③>⑤>②>④>①;
(5)该反应中Mn元素化合价由+7价变为+2价、C元素化合价由+3价变为+3价,转移电子数为10,根据转移电子相等、原子守恒、电荷守恒配平方程式为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O;
消耗KMnO4的物质的量为:0.016L×0.1mol/L=0.0016mol,根据方程式5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O可知还原剂H2C2O4、KHC2O4的总物质的量为:0.0016mol×$\frac{5}{2}$=0.004mol,
设25mL溶液中H2C2O4、KHC2O4的物质的量分别为xmol、ymol,则:
H2C2O4~2NaOH KHC2O4~NaOH
xmol 2xmol ymol ymol
由题意可知:$\left\{\begin{array}{l}{2x+y=0.005}\\{x+y=0.004}\end{array}\right.$,
解得:x=0.001、y=0.003,
原样品中H2C2O4•2H2O的质量分数为:$\frac{0.001mol×\frac{25mL}{250mL}×126g/mol}{6g}×100%$=21%;
KHC2O4的质量分数为:$\frac{0.003mol×\frac{25mL}{250mL}×128g/mol}{6g}$×100%=64%,
故答案为:5;2;16;10;2;8;21%;64%.
点评 本题考查较综合,涉及氧化还原反应方程式的配平、根据方程式计算、弱电解质的电离及离子浓度大小比较等知识点,侧重考查基本概念基本理论及分析计算能力,难点是(4)题水解程度大小比较及(5)题计算,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F | |
| B. | 人们可在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料 | |
| C. | 短周期元素正化合价数值和其族序数相同 | |
| D. | 短周期元素形成的微粒X2-与 Y2+核外电子排布相同,离子半径:X2->Y2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
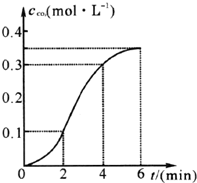 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示.下列结论不正确的是( )| A. | 反应开始2分钟内平均反应速率最大 | |
| B. | 反应4分钟后平均反应速率最小 | |
| C. | 反应开始4分钟内温度对反应速率的影响比浓度大 | |
| D. | 反应在第2分钟初至第3分钟末生成CO2的平均反应速率为0.1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔化的金属铝非常黏稠 | |
| B. | 铝的密度小,所受重力也小 | |
| C. | 大部分铝已经被氧化 | |
| D. | 氧化膜的熔点比铝高,兜住了熔化的铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分,当左边充入1molN2,右边充入8gCO和CO2的混合气体,隔板处于如图所示位置(两侧温度相同),则混合气体中CO和CO2的总物质的量为0.25mol,其中CO和CO2的分子数之比为3:1.
在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分,当左边充入1molN2,右边充入8gCO和CO2的混合气体,隔板处于如图所示位置(两侧温度相同),则混合气体中CO和CO2的总物质的量为0.25mol,其中CO和CO2的分子数之比为3:1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
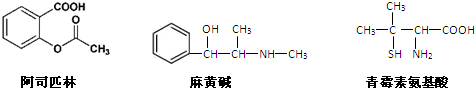
| A. | 青霉素氨基酸不能与盐酸反应,但能与NaOH溶液反应 | |
| B. | 阿司匹林能与NaOH溶液反应生成可溶性有机物 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一氯代物有3种 | |
| D. | 三种有机物都能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
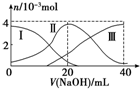 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化情况如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).根据图示判断,当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序正确的是( )| A. | c(Na+)>c(HA-)>c(OH-)>c(H2A)>c(H+)>c(A2-) | B. | c(Na+)>c(HA-)>c(H+)>c(A2-)>c(H2A)>c(OH-) | ||
| C. | c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)>c(H2A) | D. | c(Na+)>c(OH-)>c(HA-)>c(H2A)>c(H+)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
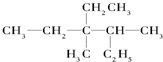 用系统命名法命名:3,4-二甲基-3-乙基己烷
用系统命名法命名:3,4-二甲基-3-乙基己烷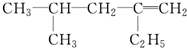
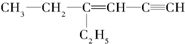 ,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个
,分子中饱和碳原子数为4个,可能在同一平面上的碳原子数最多为8个查看答案和解析>>
科目:高中化学 来源: 题型:解答题
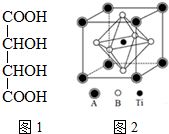 钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.
钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com