
| A. | 充电时,Zn板应与外接电源的负极相连 | |
| B. | 放电时,溶液中的OH从正极向负极移动 | |
| C. | 正极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OH- | |
| D. | 充电时,当转移0.2mol电子时,阴极质量增加3.4g |
分析 高铁电池放电时,锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,充电时为电解池,阴极、阳极电极反应式与负极、正极反应式正好相反,据此分析解答.
解答 解:A.电池放电时,锌在负极失去电子,则充电时锌极与外电源负极相连做阴极得电子,故A正确;
B.放电时OH-从正极向负极移动,故B正确;
C.电池放电时,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,故C正确;
D.充电时阴极反应式为Zn(OH)2+2e-=Zn+2OH-,所以当转移0.2mol电子时,阴极质量减少3.4g,故D错误;
故选D.
点评 本题考查化学电源新型电池,为高频考点,会根据元素化合价变化确定各个电极上发生的反应,难点是电极反应式的书写.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若C溶于水后得到强碱溶液,则A可能是Na | |
| B. | 若向C溶液中逐滴加入NaOH溶液,溶液中出现白色沉淀并逐渐消失,则A可能Al | |
| C. | 若C的溶液遇NaHCO3固体,放出CO2气体,则A可能是H2 | |
| D. | 若C的溶液中滴加NaOH产生白色沉淀,后白色沉淀消失,则B可能为Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 | 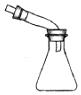 | 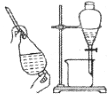 |  |
| 快速制备和收集一定量的氨气 | 蒸馏时的接收装置 | 用于分离C2H5OH和水混合物 | 直接蒸发氯化铁溶液获得氯化铁晶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L的CO气体1molN2所含的电子数也相等 | |
| B. | 7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1NA | |
| C. | 标准情况下将2.24LCl2通入到2L水中,充分反应后转移的电子数且小于0.1NA | |
| D. | 300mL2mol•L-1蔗糖溶液中所含分子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:
近年我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.回答下列问题:| 容器代号 | NO | N2 | O2 |
| A | 2 | 0 | 0 |
| B | 0 | 1 | 1 |
| C | 0.4 | 0.6 | 0.8 |
| D | 1 | 0.5 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
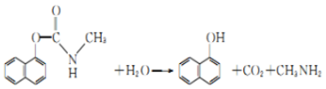
| A. | 西维因分子式为C12H10NO2 | |
| B. | 西维因分子中至少有21个原子共平面 | |
| C. | 1mol西维因最多能与6mol氢气发生加成反应 | |
| D. | 取一段时间后的混合液,先用盐酸酸化,再滴加FeCl3溶液,可检验西维因是否发生水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com