
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将某气体通入FeCl2溶液中 | 溶液由浅绿色变为黄色 | 该气体中一定含有Cl2 |
| B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体中一定含有SO2 |
| C | 将某气体通过灼热的CuO粉末 | 粉末由黑变红 | 该气体中一定含有H2 |
| D | 将某气体与湿润的红色石蕊试纸接触 | 试纸变蓝色 | 该气体中一定含有NH3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溶液由浅绿色变为黄色,说明加入的气体具有氧化性,可能为氧气或臭氧,不一定为氯气;
B.品红溶液褪色,说明该气体具有漂白性,可能为氯气和臭氧,不一定为二氧化硫;
C.CuO粉末由黑变红,该气体具有还原性,可能为CO或氢气;
D.将某气体与湿润的红色石蕊试纸接触,试纸变蓝,说明该气体为碱性气体,一定为氨气.
解答 解:A.将某气体通入FeCl2溶液中,溶液由浅绿色变为黄色,气体可能是O2、O3等,不一定为Cl2,故A错误;
B.将某气体通入品红溶液中,品红溶液褪色,气体可能是Cl2、O3等,不一定为SO2,故B错误;
C.将某气体通过灼热的CuO粉末,粉末由黑变红,该气体可能为CO,不一定为H2,故C错误;
D.将某气体与湿润的红色石蕊试纸接触,试纸变蓝色,该气体为碱性气体,只能为氨气,故D正确;
故选D.
点评 本题考查了实验方案的评价,题目难度中等,侧重考查常见气体性质及检验,明确常见气体的化学性质及检验方法为解答关键,试题培养了学生的分析能力及化学实验能力.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:实验题

| 压强/Mpa C% 温度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将得到的m g固体放到氧气中充分灼烧后,固体质量变为4.8 g | |
| B. | 生成的CO2已被Ba(OH)2溶液完全吸收,Ba2+沉淀完全 | |
| C. | Ba(OH)2溶液吸收CO2后的溶液中有BaCO3和Ba(HCO3)2,且物质的量的比为2:1 | |
| D. | 原混合物中CuO与Fe2O3的质量比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(H2)=0.1 mol•L-1•S-1? | B. | V(N2)=0.2 mol•L-1•S-1? | ||
| C. | V(NH3)=0.15 mol•L-1•S-1? | D. | V(H2)=18 mol•L-1•min-1? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )
如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KCl 溶液和琼胶做成的冻胶)( )| A. | 该原电池的总反应式为2Fe3++Cu=Cu2++2Fe2+ | |
| B. | 该电池工作时,盐桥中K+向石墨电极定向移动 | |
| C. | 若用此电池电解饱和食盐水制取Cl2,当铜电极的质量减少6.4g时,产生氯气的体积为2.24 L | |
| D. | 电池工作过程中,电子由铜电极经过电流表流向石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
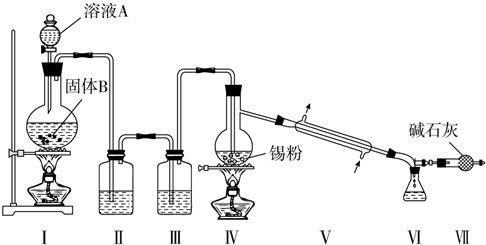
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
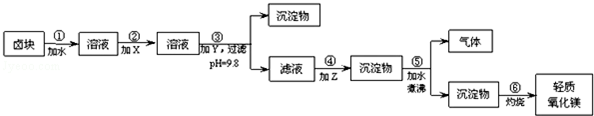
| 物质 | 价格/元•吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com