
| A、P2O5可用于干燥Cl2和NH3 |
| B、“可燃冰”主要成分是甲烷和水 |
| C、CCl4可用于鉴别溴水和碘水 |
| D、Si和SiO2都用于制造光导纤维 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| B、电解精炼铜时阴极发生还原反应 |
| C、用铜作电极电解后的硫酸铜溶液中,加入一定量的氧化铜即可恢复溶液的成分和浓度 |
| D、铜锌原电池工作时外电路电子由锌极流向铜极,内电路电子由铜极流向锌极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 分别向蛋白质溶液中滴加硫酸、烧碱溶液、饱和NH4Cl溶液、75%的乙醇溶液等 | 均有固体析出 | 均发生变性 |
| B | 向某溶液中滴加KMnO4 | 紫色褪去 | 原溶液中一定有Fe2+ |
| C | Fe与稀HNO3、稀H2SO4反应 | 产生气体 | 均发生置换反应 |
| D | 向AgCl悬浊液中滴加Na2S溶液 | 白色沉淀变成黑色 | 2AgCl(s)+S2-(aq)═Ag2S(s)+2Cl-(aq) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
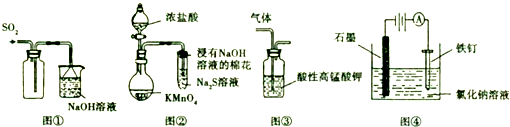
| A、可用图①所示装置收集SO2 |
| B、可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
| C、可用图③所示装置除去CH4中混有的少量C2H4 |
| D、可用图④所示装置防止铁钉生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
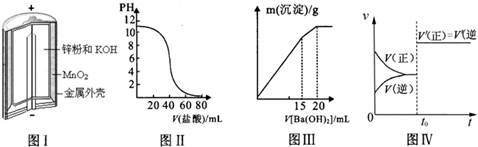
| A、图Ⅰ所示锌锰碱性电池正极的电极反应式为:MnO2+H2O+2e-═MnOOH+OH- |
| B、图Ⅱ表示盐酸滴加到0.1mol?L-1某碱溶液中得到的滴定曲线,由图Ⅱ可知二者恰 好中和时,所得溶液的pH>7 |
| C、图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液时,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D、图Ⅳ表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
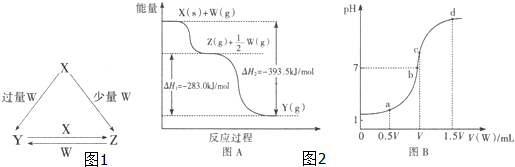
| 1 |
| 2 |
| 1 |
| 2 |
| A、△H1>△H2;△H3>△H4 |
| B、△H1>△H2;△H3<△H4 |
| C、△H1=△H2;△H3<△H4 |
| D、△H1<△H2;△H3>△H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
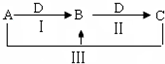 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com