
分析 由淀粉$→_{△}^{稀硫酸}$A→B→C→醋酸可知,A为葡萄糖,A发生酒化反应生成B为CH3CH2OH,C为CH3CHO,C氧化生成醋酸,
(1)C为乙醛;
(2)B为CH3CH2OH,C为CH3CHO,-OH转化为-CHO;
(3)由醋酸制备醋酸甲酯,为乙酸与甲醇发生酯化反应;
(4)由B可制备乙烯气体,乙烯含碳碳双键,可与溴水发生加成反应.
解答 解:由淀粉$→_{△}^{稀硫酸}$A→B→C→醋酸可知,A为葡萄糖,A发生酒化反应生成B为CH3CH2OH,C为CH3CHO,C氧化生成醋酸,
(1)C中官能团的名称是醛基,故答案为:醛基;
(2)B为CH3CH2OH,C为CH3CHO,-OH转化为-CHO,则B→C的反应类型是氧化反应,故答案为:C;
(3)由醋酸制备醋酸甲酯的化学反应方程式为CH3COOH+CH3OH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH3+H2O,
故答案为:CH3COOH+CH3OH$→_{△}^{浓H_{2}SO_{4}}$CH3COOCH3+H2O;
(4)乙烯含碳碳双键,可与溴水发生加成反应,则乙烯气体通入溴水中出现的现象为红棕色褪去且溶液分层,
故答案为:红棕色褪去且溶液分层.
点评 本题考查有机物的推断,为高频考点,把握有机物的性质、官能团的变化、有机反应为解答的关键,侧重分析与推断能力的考查,注意A转化为B为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
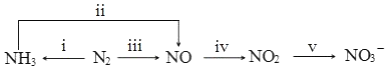
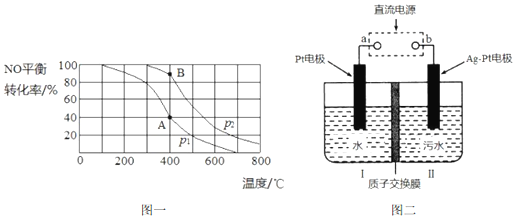
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3 | |
| B. | 除去NaCl溶液中少量的Na2S:加入AgCl后再过滤 | |
| C. | 向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3 | |
| D. | 除去FeCl3溶液中少量的CuCl2:加入足量铁粉,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(O2)>m(CO2) | |
| B. | 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(02)>ρ(C02) | |
| C. | 当它们的质量和温度、压强均相同时,三种气体的体积:V(CO2)>V(O2)>V(H2) | |
| D. | 当它们的温度和密度都相同时,三种气体的压强:P(H2)>P(O2)>P(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
| A. | 阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3 | |
| B. | 相同条件下的酸性:H2CO3<HCN | |
| C. | 三种溶液中均存在电离平衡和水解平衡 | |
| D. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 ol•L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要称量NaClO固体的质量为144.0 g | |
| B. | 如图所示的仪器中,有四种是不需要的,另外还需一种玻璃仪器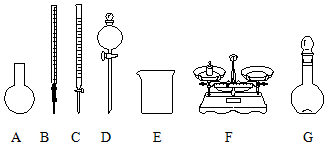 | |
| C. | 配制的溶液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 | |
| D. | 容量瓶用蒸馏水洗净后应烘干才能用于溶液配制,否则结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +172.22kJ/mol | B. | -172.22kJ/mol | C. | -392.92kJ/mol | D. | +392.92kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3O2(g)=2O3(g)△H>0,则可判定O2(g)比O3(g)稳定 | |
| B. | 由1 mol H2形成2 mol H要放出热量 | |
| C. | 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-2Q kJ/mol | |
| D. | 已知Ni(CO)4(g)=Ni(s)+4CO(g)△H=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g)△H=-Q kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com